题目内容
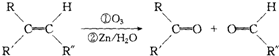
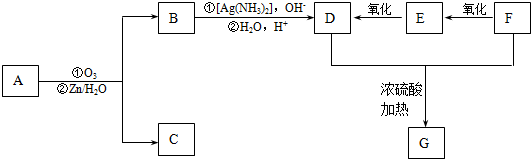
1.有机物A(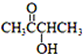 )有如下转化关系,且 1mol B反应生成了2mol C.
)有如下转化关系,且 1mol B反应生成了2mol C.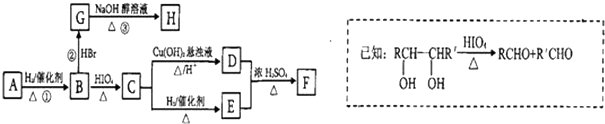
请回答下列问题:
(1)C→E的反应类型为加成反应.
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.09%,则由A合成H的总产率为66.3%.
(3)F的名称为乙酸乙酯
(4)写出C与银氨溶液反应的离子方程式为CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O.
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为:
 .
.(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为
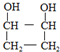 .
.
分析 由于A分子中C、H、O三种元素的质量比为6:1:4可知C、H、O的物质的量之比为2:4:1;又由于A的质谱图中质荷比最大值为88,所以A的分子式为C4H8O2,根据分子式可知A中有一个不饱和度,又不能使Br2的CCl4溶液褪色,所以A中存在C=O键,再根据1mol B反应生成了2mol C,结合已知条件可推知A的结构为:CH3COCH(OH)CH3,这样可以进一步推出B、C、D、E、F的结构简式,它们依次是:CH3CH(OH)CH(OH)CH3、CH3CHO、CH3COOH、CH3CH2OH、CH3COOCH2CH3,由于B与HBr发生取代反应生成卤代物,再在NaOH醇溶液中发生消去反应,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构分别为:CH3CHBrCHBrCH3、H3CC≡CCH3,据此分析解答.
解答 解:由于A分子中C、H、O三种元素的质量比为6:1:4可知C、H、O的物质的量之比为2:4:1;又由于A的质谱图中质荷比最大值为88,所以A的分子式为C4H8O2,根据分子式可知A中有一个不饱和度,又不能使Br2的CCl4溶液褪色,所以A中存在C=O键,再根据1mol B反应生成了2mol C,结合已知条件可推知A的结构为:CH3COCH(OH)CH3,这样可以进一步推出B、C、D、E、F的结构简式,它们依次是:CH3CH(OH)CH(OH)CH3、CH3CHO、CH3COOH、CH3CH2OH、CH3COOCH2CH3,由于B与HBr发生取代反应生成卤代物,再在NaOH醇溶液中发生消去反应,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构分别为:CH3CHBrCHBrCH3、H3CC≡CCH3,
(1)比较C和E的结构可知,E中氢原子个数比C中多2个,其它原子没有变化再根据反应条件可知该反应为加成反应,故答案为:加成反应;
(2)由A合成H的总产率应为①,②、③三步反应的产率之积,所以由A合成H的总产率=93.0%×81.0%×88.09%=66.3%,故答案为:66.3%;
(3)F为CH3COOCH2CH3,其名称为乙酸乙酯,故答案为:乙酸乙酯;
(4)由上面的分析可知,C为乙醛,它与银氨溶液反应的离子方程式为:CH3CHO+2[Ag(NH3)2]++2OH- $\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2[Ag(NH3)2]++2OH- $\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O;
(5)由于B是2,3-丁二醇,与HBr发生取代反应生成卤代物 ,再在NaOH醇溶液中发生消去反应生成H,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构,G为
,再在NaOH醇溶液中发生消去反应生成H,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构,G为 H为
H为 ,G转化为H的化学方程式为
,G转化为H的化学方程式为 ,故答案为:
,故答案为:
(6)A的结构为: ,其中有8个氢原子,而X中核磁共振氢谱只有3个峰,峰面积之比为1:1:2,所以X是一个非常对称的结构,X中两个氧原子,且1mol X可在HIO4加热的条件下反应,产物只有1mol Y,结合题目信息,说明X中有两个羟基,合X的不饱和度是1,有四个碳原子,所以X中有由四个碳原子构成的环,由此X的结构可以写成
,其中有8个氢原子,而X中核磁共振氢谱只有3个峰,峰面积之比为1:1:2,所以X是一个非常对称的结构,X中两个氧原子,且1mol X可在HIO4加热的条件下反应,产物只有1mol Y,结合题目信息,说明X中有两个羟基,合X的不饱和度是1,有四个碳原子,所以X中有由四个碳原子构成的环,由此X的结构可以写成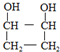 ,故答案为:
,故答案为: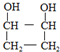 .
.
点评 本题考查了有机官能团的性质、有机结构的推断、有机反应类型、同分异构体的书写等知识,中等难度,解题的难点在第(6)小问,写有条件的同分异构体,对学生掌握有机结构特点及从题中获取信息并灵活运用能力要求较高.

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ/mol | |
| B. | 由4P(s,红磷)=P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 | |
| C. | 己知:S(g)+O2(g)=SO2(g);△H1及S(s)+O2(g)=SO2(g):△H2,则△H1<△H2 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
按要求回答下列问题.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)元素①的单质在氧气中燃烧,生成的氧化物的化学式是Na2O2,该化合物呈淡黄色.
(3)第3周期主族元素中,元素原子半径最小的是Cl(填元素符号).
(4)元素⑨的原子最外层电子数为5.
(5)元素⑤的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称).
(6)元素⑦、⑩中,化学性质较不活泼的元素是Br(填元素符号).
(7)元素④的氢化物化学式CH4,元素②的最高价氧化物对应的水化物的化学式Mg(OH)2.
(8)元素③的氢氧化物和稀盐酸反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 熵值增大的反应都能自发进行 | |
| C. | 由能量判据和熵判据组合而成的复合判据,适合于所有的反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
已知:(1)25℃时,几种硫化物的溶度积常数如下:
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5×10-18 | 4.6×10-14 | 2×10-54 |
| Fe(OH)2 | Fe(OH)3 | Mn (OH)2 | |
| 开始沉淀时的PH | 6.3 | 2.7 | 8.3 |
| 沉淀完全时的PH | 8.4 | 3.7 | 9.8 |
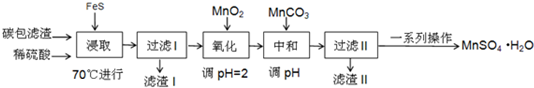
(1)“浸取”时加热的作用是提高浸取的反应速率;
写出“浸取”时生成MnSO4、Fe2(SO4)3 反应的离子方程式:9MnO2+2FeS+20H+=9Mn2++2Fe3++2SO42-+10H2O.
(2)若“浸取”在25℃时进行,加入足量FeS,则FeS(s)+Hg2+(aq)?HgS(s)+Fe2+ (aq)的平衡常数K为2.5×1036.
(3)过滤I过程中,需要使用的玻璃仪器有烧杯、漏斗、玻璃棒,滤渣I的主要成分为FeS、S 和HgS和C(化学式).
(4)“氧化”时加入MnO2 的作用是将Fe2+全部氧化为Fe3+,也可用H2O2 代替MnO2 ,H2O2 的电子式为
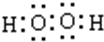 .
.(5)“中和”过程,应该调节溶液PH为3.7≤PH<8.3,写出该过程产生滤渣II的离子方程式:2Fe3++3MnCO3+3H2O=2Fe(OH)3+3Mn2++3CO2↑
(6)获得MnSO4•H2O的“一系列操作”是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(7)1150℃时,MnSO4•H2O 在氩气氛围中进行焙烧的分解产物是Mn3O4、硫的氧化物等,分解反应的化学方程式是:3MnSO4•H2O$\frac{\underline{\;高温\;}}{\;}$Mn3O4+SO2↑+2SO3↑+3H20,在MnSO4•H2O进行焙烧时,除加热仪器外,还需要的仪器中主要成分属硅酸盐的有坩埚、泥三角.
| A. | 可溶性铜盐有毒,故人体内不存在铜元素 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | 宇航服主要成分是由碳化硅陶瓷和碳纤维复合而成,是一种新型无机非金属材料 | |
| D. | 中秋佳节月饼中用小袋包装的铁粉来防止月饼氧化变质 |
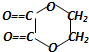 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.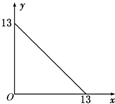 某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题: