题目内容
电浮选凝聚法处理酸性污水的工作原理如图.下列说法不正确的是( )

| A、铁电极发生的电极反应式为:Fe-2e-=Fe2+ |
| B、通入甲烷的电极反应式为:CH4+4CO32--8e-=5CO2+2H2O |
| C、为增强污水的导电能力,可向污水中加入适量工业用食盐 |
| D、若左池石墨电极产生44.8L(标况)气体,则消耗0.5 mol氧气 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲烷燃料电池中,通入甲烷的一极为原电池的负极,发生氧化反应,电极方程式为CH4+4CO32--8e-═5CO2+2H2O,通入氧气的一极为原电池的正极,发生还原反应,电极方程式为O2+2CO2+4e-=2CO32-,铁连接原电池的正极,为电解池的阳极,被氧化,发生Fe-2e-=Fe2+,阴极生成2H++2e-=H2↑,结合电子的转移和电极方程式解答该题.
解答:
解:A.通入氧气的电极上得电子发生还原反应,所以通入氧气的电极为正极,则铁作阳极,阳极上铁失电子发生氧化反应,电极反应式为Fe-2e-═Fe2+,故A正确;
B.甲烷的一极为原电池的负极,发生氧化反应,电极方程式为CH4+4CO32--8e-═5CO2+2H2O,故B正确;
C.水是弱电解质,其导电能力较小,为了增强溶液的导电能力而加入强电解质,故C正确;
D.石墨电极上析出的气体为氢气,生成44.8L即2mol氢气转移电子的物质的量=
×2=4mol,根据转移电子相等得,消耗氧气的物质的量为1mol,故D错误;
故选D.
B.甲烷的一极为原电池的负极,发生氧化反应,电极方程式为CH4+4CO32--8e-═5CO2+2H2O,故B正确;
C.水是弱电解质,其导电能力较小,为了增强溶液的导电能力而加入强电解质,故C正确;
D.石墨电极上析出的气体为氢气,生成44.8L即2mol氢气转移电子的物质的量=
| 44.8L |
| 22.4L/mol |
故选D.
点评:本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,结合转移电子相等进行计算,难点的电极反应式的书写,要结合电解质书写,难度中等.

练习册系列答案
相关题目
甲醇燃料电池结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2═2CO2+4H2O.下列说法不正确的是( )


| A、右电极为电池正极,左电极为电池负极 |
| B、a处通入空气,b处通入甲醇 |
| C、负极反应式为:CH3OH+H2O-6e-═CO2+6H+ |
| D、正极反应式为:O2+4H++4e-═2H2O |
下列各组离子在水溶液中能大量共存,但用盐酸酸化后,不能大量共存的是( )
| A、Fe3+、K+、NO3-、SO42- |
| B、Al3+、Na+、HCO3-、SO42- |
| C、NO3-、K+、Al(OH)4-、HSO3- |
| D、Na+、K+、S2O32-、Cl- |
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A、离O点越远的元素原子半径越大 |
| B、虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族 |
| C、B元素是图中金属性最强的元素 |
| D、B、C最高价氧化物的水化物可以相互反应 |
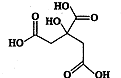 物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )
物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )| A、X的分子式为C6H7O7 |
| B、1 mol物质x最多可以和3 mol氢气发生加成反应 |
| C、X分子内所有原子均在同一平面内 |
| D、足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同 |
向100mL0.1mol/L的氢氧化钠溶液中缓慢通入一定量的CO2气体,下列有关反应后的溶液说法错误的是( )
| A、该溶液中一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B、该溶液中可能存在:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
| C、向该溶液中滴入少量稀盐酸,一定会产生气泡 |
| D、向该溶液中滴入少量Ca(OH)2溶液,一定会有白色沉淀产生 |
将100g CaCO3与一定量SiO2在高温下充分反应,产生的气体在标况下的体积为( )
| A、22.4㎡ |
| B、22.4L |
| C、11.2L |
| D、2.24L |