题目内容
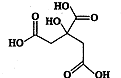 物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )
物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )| A、X的分子式为C6H7O7 |
| B、1 mol物质x最多可以和3 mol氢气发生加成反应 |
| C、X分子内所有原子均在同一平面内 |
| D、足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同 |
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:由结合简式可知,分子中含-COOH、-OH,结合羧酸、醇的性质来解答.
解答:
解:A.由结构简式可知,X的分子式为C6H8O7,故A错误;
B.-COOH不能与氢气发生加成反应,故B错误;
C.除-COOH外的3个C均为四面体构型,不可能所有原子均在同一平面内,故C错误;
D.等物质的量的NaHCO3、Na2CO3反应,含C原子的物质的量相同,足量X与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同,故D正确;
故选D.
B.-COOH不能与氢气发生加成反应,故B错误;
C.除-COOH外的3个C均为四面体构型,不可能所有原子均在同一平面内,故C错误;
D.等物质的量的NaHCO3、Na2CO3反应,含C原子的物质的量相同,足量X与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同,故D正确;
故选D.
点评:本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重羧酸和醇性质的考查,选项B、C为解答的难点,题目难度不大.

练习册系列答案
相关题目
已知两种弱酸的酸性:HA>HB,在常温下下列各项比较中正确的是( )
| A、等物质的量浓度的HA溶液与NaB溶液等体积的混合液中:2c(Na+)═c(A-)+c(B-)+c(HA)+c(HB) |
| B、pH相等的NaA与KB两溶液中:[c(Na+)-c(A-)]<[c(K+)-c(B-)] |
| C、pH=9的三种溶液 ①NaB ②NH3?H2O ③NaOH中由水电离出的c(OH-):①>②>③ |
| D、两种溶液①0.1mol/L HA溶液 ②0.1mol/L HB溶液,加水稀释至pH 相同,需加水的量前者小于后者 |
NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、标准状态下,22.4L水中含有的氧原子数为NA |
| B、常温常压下,8gO2含有4 NA个电子 |
| C、25℃时,pH=13的1L Ba(OH)2溶液中含有OH-的数目为0.2NA |
| D、53.5gNH4Cl中含有H-Cl键的个数为4NA |
下列离子方程式书写错误的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B、Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-=AlO2-+2H2O |
| C、Ca(OH)2溶液中通入足量的CO2:CO2+OH-=HCO3- |
| D、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O |
下列有关说法正确的是( )
| A、室温下,反应CaCO3(s)═CaO(s)+CO2(g)不能自发进行,说明该反应的△H>0、△S<0 |
| B、饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变 |
| C、Na2CO3溶液加水稀释后,恢复至原温度,溶液pH和Kw均减小 |
| D、在0.l mol?L-1的稀硫酸加水稀释的过程中,c(H+):c(SO42-)始终为2:1 |
电浮选凝聚法处理酸性污水的工作原理如图.下列说法不正确的是( )

| A、铁电极发生的电极反应式为:Fe-2e-=Fe2+ |
| B、通入甲烷的电极反应式为:CH4+4CO32--8e-=5CO2+2H2O |
| C、为增强污水的导电能力,可向污水中加入适量工业用食盐 |
| D、若左池石墨电极产生44.8L(标况)气体,则消耗0.5 mol氧气 |
下列是工业上制备对苯二酚的两条合成线路,有关说法正确的是( )
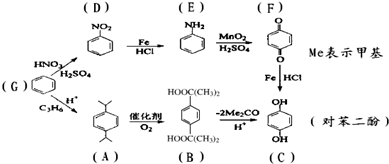

| A、G→D和D→E的反应都属于取代反应 |
| B、B有机物中含有的官能团是羧基 |
| C、G→A,A→B这两步反应都可以做到原子被100%利用 |
| D、对苯二酚可以发生取代、加成、还原、氧化、缩聚和水解反应 |
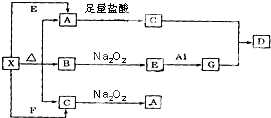 如图表示的反应关系中,部分产物被略去.已知白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C.X、E、G的焰色反应均为黄色,D为白色沉淀.
如图表示的反应关系中,部分产物被略去.已知白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C.X、E、G的焰色反应均为黄色,D为白色沉淀.