题目内容
7.测定硫酸铜晶体(CuSO4•5H2O)里结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.001g为止 ⑦根据实验数据计算硫酸铜结晶水的含量.请回答下列问题:
(1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是研钵、电子天平、酒精灯;
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?答:冷却,防止吸收水分;
(3)实验步骤⑥的目的是检验样品中的结晶水是否已经全部除去;
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号):BD.
A.加热前所用的坩埚未完全干燥
B.实验前被测样品已有部分失水
C.被测样品中含有加热易挥发的杂质
D.被测样品中含有加热不挥发的杂质.
分析 (1)还需要将晶体研碎的仪器、称量药品的仪器、加热仪器;
(2)冷却药品时需要在干燥器中进行,防止药品吸收空气中水分;
(3)实验步骤⑥是检验结晶水水分完全除去;
(4)A.加热前所用的坩埚未完全干燥,导致加热前后质量减少偏大;
B.实验前被测样品已有部分失水,导致加热前后质量减少偏少;
C.被测样品中含有加热易挥发的杂质,导致加热前后质量减少偏大;
D.被测样品中含有加热不挥发的杂质,导致加热前后质量减少偏少.
解答 解:(1)还需要将晶体研碎的仪器研钵、称量药品的仪器电子天平、加热仪器酒精灯,故答案为:研钵、电子天平、酒精灯;
(2)冷却药品时需要在干燥器中进行,防止药品吸收空气中水分而导致测定值偏小,故答案为:冷却,防止吸水;
(3)反应前后质量减少的质量认为是结晶水的质量,所以实验步骤⑥是检验结晶水水分完全除去,当连续两次称量的质量差不超过0.001g时停止加热,故答案为:检验样品中的结晶水是否已经全部除去;
(4)A.加热前所用的坩埚未完全干燥,导致加热前后质量减少偏大,质量减少量认为是结晶水的质量,所以导致测定值偏高,故错误;
B.实验前被测样品已有部分失水,导致加热前后质量减少偏少,质量减少量认为是结晶水的质量,所以导致测定值偏低,故正确;
C.被测样品中含有加热易挥发的杂质,导致加热前后质量减少偏大,质量减少量认为是结晶水的质量,所以导致测定值偏高,故错误;
D.被测样品中含有加热不挥发的杂质,导致加热前后质量减少偏少,质量减少量认为是结晶水的质量,所以导致测定值偏低,故正确,
故选BD.
点评 本题考查结晶水测定,为高频考点,侧重考查学生实验操作及实验评价能力,明确实验原理及仪器用途是解本题关键,误差分析是易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17. 甲酸甲酯水解反应方程式为:
甲酸甲酯水解反应方程式为:
HCOOCH3(l)+H2O(l)?HCOOH(l)+CH3OH(l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如表:
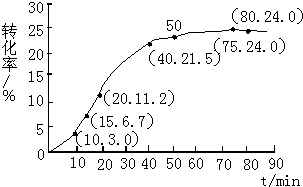
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如图:
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见表:
请计算15~20min范围内甲酸甲酯的减少量为0.045mol,甲酸甲酯的平均反应速率为0.009mol•min-1(不要求写出计算过程).
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
(3)上述反应的平衡常数表达式为:K=$\frac{c(HCOOH)•c(C{H}_{3}OH)}{c(HCOOC{H}_{3})•c({H}_{2}O)}$,则该反应在温度T1下的K值为$\frac{1}{7}$.
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
 甲酸甲酯水解反应方程式为:
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)?HCOOH(l)+CH3OH(l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如表:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见表:
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol•min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
(3)上述反应的平衡常数表达式为:K=$\frac{c(HCOOH)•c(C{H}_{3}OH)}{c(HCOOC{H}_{3})•c({H}_{2}O)}$,则该反应在温度T1下的K值为$\frac{1}{7}$.
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
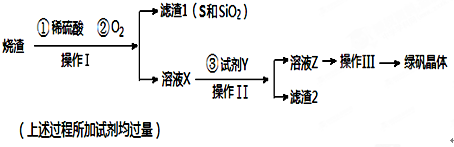
18.孔雀石的主要成分为Cu2(OH)2CO3还含少量二价铁和三价铁的氧化物及硅的氧化物.如图是实验室以孔雀石为原料制备CuSO4•5H2O晶体的流程图: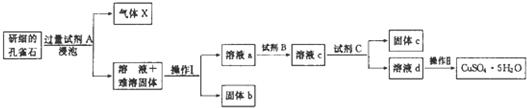
(1)试剂A的化学式是H2SO4;操作I的名称是过滤;
(2)操作Ⅱ的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;用到的仪器有:酒精灯、玻璃棒、蒸发皿、坩埚钳和三角架.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
写出相应反应的离子方式:2Fe2++2H++H2O2=2Fe3++2H2O.
(4)已知
试剂C的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离.试剂C宜选用D(填选项序号);
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuCO3
为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7~4.8.
(5)溶液c中含有的两种金属阳离子,若用色谱分析法检验,固定相是附着在滤纸上的水,滤纸的作用是惰性支持物.在流动相中分配较少的离子是Cu2+、氨熏后的颜色是深蓝色,其氨熏时的离子方程式为Cu2++4NH3•H20═[Cu(NH3)4]2++4H2O.

(1)试剂A的化学式是H2SO4;操作I的名称是过滤;
(2)操作Ⅱ的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;用到的仪器有:酒精灯、玻璃棒、蒸发皿、坩埚钳和三角架.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
写出相应反应的离子方式:2Fe2++2H++H2O2=2Fe3++2H2O.
(4)已知
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuCO3
为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7~4.8.
(5)溶液c中含有的两种金属阳离子,若用色谱分析法检验,固定相是附着在滤纸上的水,滤纸的作用是惰性支持物.在流动相中分配较少的离子是Cu2+、氨熏后的颜色是深蓝色,其氨熏时的离子方程式为Cu2++4NH3•H20═[Cu(NH3)4]2++4H2O.
15. 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
(1)硒(Se)的最高价氧化物水化物的化学式为H2SeO4;该族2~5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,请写出1mol硒与H2反应生成气态氢化物的热化学方程式H2(g)+Se(s)═H2Se(g)H=+29.7kJ/mol
a.+99.7kJ•mol-1 b.+29.7kJ•mol-1c.-20.6kJ•mol-1 d.-241.8kJ•mol-1
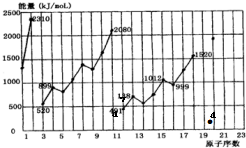
(2)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示.试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题.
同周期内,随原子序数增大,E值增大.但个别元素的E值出现反常现象.试预测下列关系式中正确的是ac(填写编号,多选倒扣)
a、E(砷)>E(硒)
b、E(砷)<E(硒)
c、E(溴)>E(硒)
d、E(溴)<E(硒)
估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围419<E<738.
 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.| 磷 | 硫 | ||
| 砷 | 硒 |
a.+99.7kJ•mol-1 b.+29.7kJ•mol-1c.-20.6kJ•mol-1 d.-241.8kJ•mol-1
(2)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示.试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题.
同周期内,随原子序数增大,E值增大.但个别元素的E值出现反常现象.试预测下列关系式中正确的是ac(填写编号,多选倒扣)
a、E(砷)>E(硒)
b、E(砷)<E(硒)
c、E(溴)>E(硒)
d、E(溴)<E(硒)
估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围419<E<738.
12. (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
试计算该反应的反应热△H=+125kJ/mol.
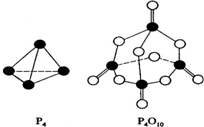
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S).已知断裂下列化学键需要吸收的能量分别为如下
根据图示的分子结构和有关数据估算该反应的△H=819kJ•mol-1;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4 (1)△H1=-195.0kJ•mol-1
②N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol.
 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S).已知断裂下列化学键需要吸收的能量分别为如下
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4 (1)△H1=-195.0kJ•mol-1
②N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol.
17.关于粗盐提纯的下列说法中正确的是( )
| A. | 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 除去粗盐中的Mg2+应加入过量的KOH,然后过滤 | |
| D. | 粗盐提纯最后一步应向滤液中加入盐酸,调节溶液的值 |

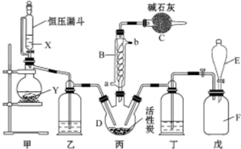 磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.
磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.