题目内容
17. 甲酸甲酯水解反应方程式为:
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)?HCOOH(l)+CH3OH(l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如表:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见表:
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol•min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
(3)上述反应的平衡常数表达式为:K=$\frac{c(HCOOH)•c(C{H}_{3}OH)}{c(HCOOC{H}_{3})•c({H}_{2}O)}$,则该反应在温度T1下的K值为$\frac{1}{7}$.
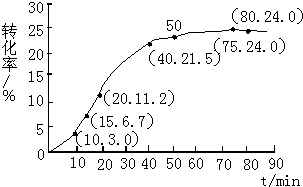
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
分析 (1)由图表可知,15min时,甲酸甲酯的转化率为6.7%;20min时,甲酸甲酯的转化率为11.2%,两次时刻剩余的甲酸甲酯的物质的量之差,即为15~20min范围内甲酸甲酯的减少量;
根据题目图表可知反应速率为单位时间内物质的量的变化,15~20min范围内甲酸甲酯的平均速率为$\frac{△n}{△t}$,据此求解;
(2)甲酸具有催化作用,加快反应,开始氢离子浓度小,催化效果不明显,随着反应进行氢离子浓度增大,催化效果明显,甲酸增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,当达到平衡时,反应速率几乎不变;
(3)由图象与表格可知,在75min时达到平衡,甲酸甲酯的转化率为24%,计算出平衡时反应混合物各物质的物质的量,代入表达式计算;
(4)因为升高温度,反应速率增大,达到平衡所需时间减少,又该反应是吸热反应,升高温度平衡向逆反应方向移动,甲酸甲酯的转化率减小.
解答 解:(1)15min时,甲酸甲酯的转化率为6.7%,所以15min时,甲酸甲酯的物质的量为1-1.00mol×6.7%=0.933mol;20min时,甲酸甲酯的转化率为11.2%所以20min时,甲酸甲酯的物质的量为1-1.00mol×11.2%=0.888mol,所以15至20min甲酸甲酯的减少量为0.933mol-0.888mol=0.045mol,则甲酸甲酯的平均速率=0.045mol/5min=0.009mol•min-1.
故答案为:0.045;0.009;
(2)从题给数据不难看出,平均速率的变化随转化率的增大先增大再减小,后保持不变.因为反应开始甲酸甲酯的浓度大,所以反应速率较大,后随着反应进行甲酸甲酯的浓度减小,反应速率减小,当达到平衡时,反应速率几乎不变,其规律及原因如下:
①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零,
故答案为:①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢.
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大.
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零.
(3)由图象与表格可知,在75min时达到平衡,甲酸甲酯的转化率为24%,所以甲酸甲酯转化的物质的量为1.00×24%=0.24mol,结合方程式可计算得平衡时,甲酸甲酯物质的量=0.76mol,水的物质的量1.75mol,甲酸的物质的量=0.25mol,甲醇的物质的量=0.76mol.所以K=(0.76×0.25)/(1.75×0.76)=1/7.
故答案为:$\frac{1}{7}$;
(4)因为升高温度,反应速率增大,达到平衡所需时间减少,所以绘图时要注意T2达到平衡的时间要小于T1,又该反应是吸热反应,升高温度平衡向正反应方向移动,甲酸甲酯的转化率增大,所以绘图时要注意T2达到平衡时的平台要高于T1.图象为 ,
,
故答案为:
点评 本题考查考生对化学反应速率概念,化学平衡的了解及其影响因素的理解,为高考常见题型,侧重学生的分析、计算能力的考查,对化学平衡常数简单计算的掌握,注重考查学生知识迁移、读图及表达能力.

 教学练新同步练习系列答案
教学练新同步练习系列答案| A. | 生成0.025 mol P2O5 | |
| B. | 生成 P2O3所释放的热量为(Y-0.05X) kJ | |
| C. | 2P(s)+$\frac{3}{2}$O2(g)=P2O3(s)△H=-(40Y-2X)kJ•mol-1 | |
| D. | 生成的 P2O3与 P2O5的质量之比为 1:1 |
(1)已知2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225kJ.mol-1
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ.mol-1) | 390 | 190 | 946 | 460 |
(2)800℃时,某密闭容器中存在如下反应:2NO2(g)?2NO(g)+O2(g)△H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线Ⅰ所示.

①请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线.
②800℃时,若开始时向容器中同时加入1mol/L NO、0.2mol/L O2、0.5mol/L NO2,则v(正)>v(逆)(填“>”或“<”或“=”或“无法确定”).
(3)己知N2O4(g)?2NO2(g)△H=+57.20 kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,两种物质的浓度随时间变化关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②前10min内用NO2表示的反应速率为0.04mol/(L.min),20min时改变的条件是增大NO2的浓度;重新达到平衡时,NO2的百分含量b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断.
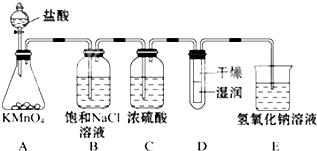 工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)
工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)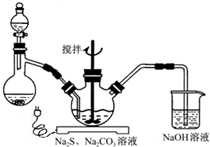 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题: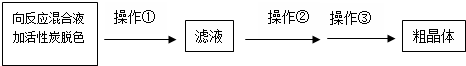
 苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线:
苯乙酸是有机合成的中间产物,下面是它的一种实验室合成路线: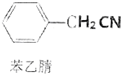 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$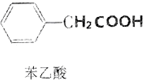 +NH4HSO4
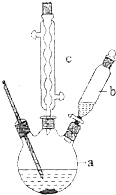
+NH4HSO4 图为实验室制溴苯的实验装置图,请根据图回答下列问题
图为实验室制溴苯的实验装置图,请根据图回答下列问题 .
.