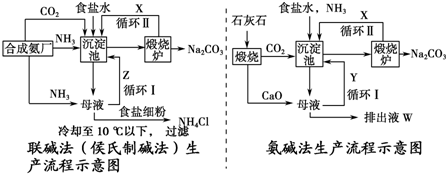
题目内容
19. 已知三个反应如下:
已知三个反应如下:Fe(s)+H2O(g)?FeO(s)+H2(g)△H1平衡常数为K1;
CO(g)+H2O(g)?H2(s)+CO2(g)△H2平衡常数为K2;
Fe(s)+CO2(g)?FeO(s)+CO(g)△H3平衡常数为K3;
在不同温度下,部分K1、K2的值如下:
| T/℃ | 700℃ | 800℃ |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 |
(2)要使反应I在一定条件下建立的平衡右移,可采取的措施有CE.(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少Fe0的量
(3)已知反应II在800℃可以自发进行,则△H2>0(填“>”、“<”或“=”),由以上信息推断反应III正反应方向为放热反应.(填“吸热”或“放热”)
(4)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应II,反应在第6min时达到平衡,反应过程中测定的部分数据见表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| N(CO)/mol | 1.20 | 0.90 | 0.80 | |
| N(H2O)/mol | 0.60 | 0.20 |
②800℃时,K2的值为1;
③若反应进行到某一时刻时,混合物中各组分的浓度分别为:c(CO)=0.002mol/L,
c(H2O)=0.003mol/L,c(CO2)=0.0025mol/L,c(H2)=0.0025moUL,则此时反应II中v(正)<v(逆).(填“>”、“<”或“=”)
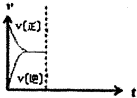
(5)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应II,当反应达到平衡后,维持温度与压强不变,t1时再通入各l mol的CO和H2O的混合气体,请在图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图.
分析 (1)根据平衡常数等于生成物浓度的幂次方之积比上反应物浓度的幂次方之积;根据方程式①、②推测出方程式③,焓变进行相应的改变,从而得出K3;
(2)根据表格数据得,升高温度,平衡常数变大,故升高温度平衡向正反应方向移动,所以正反应为吸热反应,又该反应前后气体体积不变,所以压强对该反应无影响,要使该反应向右反应方向移动,可以升高温度、增大反应物的浓度或减小生成物的浓度;
(3)随温度升高平衡常数增大,说明升高温度平衡正向移动,正反应为吸热反应,则△H>0,根据K3的变化判断反应III的反应热;
(4)①v(H2O)=$\frac{△c(H_{2}O)}{△t}$
②利用三段式计算平衡常数;
③比较Q与K;
(5)由于该反应是前后体积不变的反应,在恒压条件下,再通入各1mol的CO和H2O的混合气体,与起始量之比相同,平衡后与原平衡为等效平衡,在增加反应物的开始,容器体积增大,反应物浓度增大,生成物浓度变小,所以正反应速率变大,逆反速率减小,但最终平衡不移动,据此答题.
解答 解:(1)K1的表达式为$\frac{c({H}_{2})}{c({H}_{2}O)}$;将方程式①-②得方程式③,则K3=$\frac{{K}_{1}}{{K}_{2}}$;
故答案:$\frac{c({H}_{2})}{c({H}_{2}O)}$;$\frac{{K}_{1}}{{K}_{2}}$;
(2)A、缩小容器体积,相当于增大压强,平衡不移动,故A错误;
B、降低温度,平衡向逆反应方向移动,故B错误;
C、升高温度,平衡向正反应方向移动,故C正确;
D、使用合适的催化剂,平衡不移动,故D错误;
E、设法减少H2的量,平衡向正反应方向移动,故E正确;
F、因为氧化铁是纯固体,所以设法减少FeO的量,平衡不移动,故F错误;
故答案:CE;
(3)随温度升高平衡常数增大,说明升高温度平衡正向移动,正反应为吸热反应,则△H>0;根据K3=$\frac{{K}_{1}}{{K}_{2}}$,则在700℃K3=2.975,800℃K3=2.56,故随着温度升高K3在变小,说明平衡逆反应方向移动,反应Ⅲ的正反应为放热反应,
故答案:>;放热;
(4)①v(H2O)=$\frac{△c(H_{2}O)}{△t}$=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol/(L.min),
故答案为:0.075mol/(L.min);
②在4分钟时,水的变化的物质的量为0.4mol,根据化学方程式可知,CO的变化的物质的量也为0.4mol,所以4min时CO的物质的量为1.2mol-0.4mol=0.8mol,而6min时也是0.8mol,所以反应在4min时达到平衡,
CO(g)+H2O(g)?H2(g)+CO2(g),
起始(mol) 1.2 0.6 0 0
转化(mol) 0.4 0.4 0.4 0.4
平衡(mol) 0.8 0.2 0.4 0.4
平衡常数为K=$\frac{\frac{0.4}{2}×\frac{0.4}{2}}{\frac{0.2}{2}×\frac{0.8}{2}}$=1,
故答案为:1;
③CO(g)+H2O(g)?H2(g)+CO2(g),
某一时刻时(mol/L) 0.002 0.003 0.0025 0.0025
Q=$\frac{0.0025×0.0025}{0.002×0.003}$=1.04>1,故逆向反应,
故答案为:<;
(5)由于该反应是前后体积不变的反应,在恒压条件下,再通入各1mol的CO和H2O的混合气体,与起始量之比相同,平衡后与原平衡为等效平衡,在增加反应物的开始,容器体积增大,反应物浓度增大,生成物浓度变小,所以正反应速率变大,逆反速率减小,但最终平衡不移动,据此画出图为 ,
,
故答案为: .
.
点评 本题主要考查了反应速率的计算、化学平衡常数的计算、影响平衡移动的因素等知识点,难度不大,注意基础知识的运用.

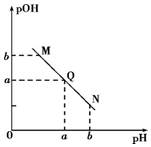
| A. | N点处pH>pOH,则N点处所示溶液呈酸性 | |
| B. | 该温度下水的离子积Kw=1×10-2a | |
| C. | Q点所示溶液呈中性,则M、N、Q三点中只有Q点溶液中水的电离出的c(H+)与水的电离c(OH-)相等 | |
| D. | M点所示溶液的导电能力强于Q |
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中滴入NaHSO3溶液,出现白色浑浊 | C6H5O-结合质子的能力比SO32-强 |
| B | 向待测液X中依次滴入氯水、KSCN溶液,溶液变红 | 待测液X中一定含有Fe2+ |
| C | 向(NH4)2S2O8溶液中加入硝酸酸化的Mn(NO3)2溶液和1滴AgNO3溶液(作催化剂),微热,溶液变紫色 | S2O82-氧化性比MnO4-强 |
| D | 浓硫酸与乙醇共热产生的气体Y,通入酸性KMnO4溶液,溶液紫色褪去 | 气体Y为纯净的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na在空气中燃烧,发出黄色火焰 | B. | Na在空气中燃烧,产物是Na2O | ||
| C. | Na是银白色金属,硬度小,熔点低 | D. | Na、K合金可作原子反应堆的导热剂 |
| A. | (m-16)g | B. | (m+16)g | C. | (m-32)g | D. | 16g |