题目内容
7.某小组同学做“硫在氧气中燃烧”的实验时,老师建议在集气瓶底部放少量NaOH溶液吸收生成的SO2.这种做法引起了同学们的思考:如何证明SO2与NaOH发生了反应呢?该小组同学查阅资料:通常状况下,1体积水约能溶解40体积SO2.SO2与NaOH、Ca(OH)2发生反应,该反应的原理、现象和CO2与NaOH、Ca(OH)2的反应相似.(1)SO2与NaOH反应的化学方程式为SO2+2NaOH=Na2SO3+H2O.
(2)甲同学向充满SO2的软塑料瓶中迅速倒入一定量NaOH溶液,拧紧瓶盖,振荡,发现塑料瓶变瘪,由此获得结论:SO2与NaOH发生了反应.乙同学认为上述实验不够严谨,理由是二氧化硫溶于水也会使塑料瓶变瘪.
(3)两同学运用控制变量的方法设计实验:向两个200mL充满SO2的软塑料瓶中分别注入a mL水和a mLNaOH溶液,振荡.则a≤5mL.两同学实施实验后,可观察到的现象为塑料瓶变瘪程度不相同,氢氧化钠溶液的塑料瓶变瘪程度大.
(4)为了进一步证明塑料瓶中SO2是否有剩余,该小组同学用两个注射器分别抽取两个塑料瓶中的剩余气体,其后续合理的实验方案为将注射器中的气体推入品红溶液中,若变红色证明气体二氧化硫剩余,若不变红色说明二氧化硫无剩余.
(5)该小组同学反思用NaOH溶液吸收生成SO2的原因是二氧化硫在氢氧化钠溶液中发生反应能吸收更多的二氧化硫气体.
分析 (1)二氧化硫和氢氧化钠溶液反应,少量氢氧化钠溶液吸收二氧化硫反应生成亚硫酸钠;
(2)气体的消耗而使瓶内的气压减小,因此瓶子会变瘪,塑料瓶变瘪,可能是二氧化硫溶于水或二氧化硫和氢氧化钠溶液反应造成;
(3)amL水和amL氢氧化钠溶液能将200 mL的SO2完全吸收,通常状况下,1体积水约能溶解40体积SO2,a=5ml,水中和氢氧化钠溶液中溶解反应的二氧化硫不同,变瘪程度不同;
(4)二氧化硫遇到品红溶液会使红色品红溶液褪色;
(5)实验分析可知氢氧化钠溶液中吸收二氧化硫多.
解答 解:(1)二氧化硫和氢氧化钠溶液反应,少量氢氧化钠溶液吸收二氧化硫反应生成亚硫酸钠,反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,
故答案为:SO2+2NaOH=Na2SO3+H2O;
(2)气体的消耗而使瓶内的气压减小,因此瓶子会变瘪,塑料瓶变瘪,可能是二氧化硫溶于水或二氧化硫和氢氧化钠溶液反应造成,塑料瓶变瘪,不一定是SO2与NaOH发生了反应.
故答案为:二氧化硫溶于水也会使塑料瓶变瘪;
(3)运用控制变量的方法设计实验,向两个200mL充满SO2的软塑料瓶中分别注入a mL水和a mLNaOH溶液,振荡,amL水和amL氢氧化钠溶液能将200 mL的SO2完全吸收,通常状况下,1体积水约能溶解40体积SO2,则a≤5ml,实验验证水中和氢氧化钠溶液中溶解反应的二氧化硫不同,变瘪程度不同,可观察到的现象为塑料瓶变瘪程度不相同,氢氧化钠溶液的塑料瓶变瘪程度大,
故答案为:5;塑料瓶变瘪程度不相同,氢氧化钠溶液的塑料瓶变瘪程度大;
(4)二氧化硫遇到品红溶液会使红色品红溶液褪色,为了进一步证明塑料瓶中SO2是否有剩余,该小组同学用两个注射器分别抽取两个塑料瓶中的剩余气体,其后续合理的实验方案为:将注射器中的气体推入品红溶液中,若变红色证明气体二氧化硫剩余,若不变红色说明二氧化硫无剩余,
故答案为:将注射器中的气体推入品红溶液中,若变红色证明气体二氧化硫剩余,若不变红色说明二氧化硫无剩余;
(5)实验分析可知氢氧化钠溶液中吸收二氧化硫多,该小组同学反思用NaOH溶液吸收生成SO2的原因是二氧化硫在氢氧化钠溶液中发生反应能吸收更多的二氧化硫气体,故答案为:二氧化硫在氢氧化钠溶液中发生反应能吸收更多的二氧化硫气体.
点评 本题考查了物质性质实验验证方法的分析判断,主要是二氧化硫性质的理解应用,掌握基础是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案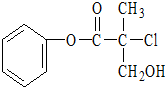 某有机物A是农药生产中的一种中间体,其结构简式如图所示:下列关于A的叙述正确的是( )
某有机物A是农药生产中的一种中间体,其结构简式如图所示:下列关于A的叙述正确的是( )| A. | 属于卤代烃,易溶于水 | |
| B. | 在酸性或碱性条件下都能发生水解反应 | |
| C. | 1molA可以与2molNaOH反应 | |
| D. | 一定条件下可发生加成反应和消去反应 |
| 选项 | 物质 | 杂质 | 试剂 | 操作方法 |
| A | 二氧化碳 | 一氧化碳 | 氢氧化钠溶液和浓硫酸 | 洗气 |
| B | 硫酸钡 | 碳酸钡 | 足量的稀硫酸 | 溶解、过滤、洗涤、烘干 |
| C | 氯化钙溶液 | 消石灰 | 过量的二氧化碳 | 过滤、蒸发、结晶 |
| D | 氨气 | 水 | 火碱溶液 | 通过盛有火碱溶液的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1 molNa2O2溶于足量水,电子转移数为NA | |
| B. | 1L0.5mol/L C2H5OH溶液中含有的氢原子数为3NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA |
 金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )| A. | 绿原酸能与FeCl3发生显色反应 | |
| B. | 1个绿原酸分子中含有4个手性碳原子 | |
| C. | 绿原酸与足量的NaOH反应,其中一种产物的化学式为C9H5O4Na3 | |
| D. | 1mol绿原酸最多能与6molH2发生反应 |
| A. | 甲烷和氯气在光照条件下反应产生油状液滴 | |
| B. | 乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 苯能使酸性高锰酸钾溶液褪色 | |
| D. | 乙醇可以和金属钠反应放出氢气 |
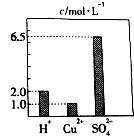 在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题:
在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题: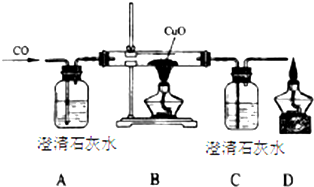 甲同学设计了如下实验装置验证一氧化碳的部分性质并验证产物.实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验.
甲同学设计了如下实验装置验证一氧化碳的部分性质并验证产物.实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验.