题目内容
18.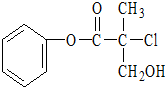 某有机物A是农药生产中的一种中间体,其结构简式如图所示:下列关于A的叙述正确的是( )
某有机物A是农药生产中的一种中间体,其结构简式如图所示:下列关于A的叙述正确的是( )| A. | 属于卤代烃,易溶于水 | |
| B. | 在酸性或碱性条件下都能发生水解反应 | |
| C. | 1molA可以与2molNaOH反应 | |
| D. | 一定条件下可发生加成反应和消去反应 |
分析 有机物由C、H、O、Cl等元素组成,属于烃的衍生物,分子中含有-COO-、-Cl、-OH等官能团,可发生水解等反应,含有苯环,还可发生加成反应,以此解答该题.
解答 解:A.有机物含有酯基,氯原子,具有酯以及氯代烃的性质,不溶于水,故A错误;
B.含有酯基,在酸性条件或碱性条件下下水解,故B正确;
C.酯基可水解生成酚羟基和羧基,氯原子和水解生成HCl,则1molA可以与3molNaOH反应,故C错误;
D.含有苯环,可发生加成反应,含有氯原子,且邻位碳原子含有H,可发生消去反应,故D正确.
故选BD.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,题目难度中等,本题注意把握有机物的结构和官能团的性质,易错点为D,注意发生消去反应的特点.

练习册系列答案
相关题目
6.下列实验设计及其对应的离子方程式均正确的是( )
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
13.配制一定体积、一定物质的量浓度的溶液,对实验结果产生偏低影响的是( )
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 溶液未冷却至室温就转移到容量瓶中定容 | |
| C. | 定容时仰视观察液面 | |
| D. | 定容时俯视观察液面 |
3.向碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到钠盐Na2H3IO6.下列有关该反应的说法中错误的是( )
| A. | 在该反应中碘酸钠作还原剂 | |
| B. | 碱性条件下,氯气的氧化性强于高碘酸钠的氧化性 | |
| C. | 反应中氧化产物与还原产物的物质的量之比为2:1 | |
| D. | 反应中生成1 mol Na2H3IO6转移2 mol电子 |
10.等物质的量的NaCl、MgCl2两种固体,其中Cl-的物质的量之比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 3:1 |
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 通常情况下,32gO2和O3的混合气体含有的分子总数小于NA | |
| B. | 常温常压下,0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| C. | 1mol有机物 中最多有6NA个原子在一条直线上 中最多有6NA个原子在一条直线上 | |
| D. | 1mol甲基 所含的电子数为7NA 所含的电子数为7NA |
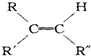 $→_{②Zn/H_{2}O}^{①O_{3}}$
$→_{②Zn/H_{2}O}^{①O_{3}}$ +
+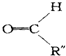 .
.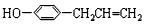 ,C
,C ,E
,E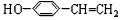 .
.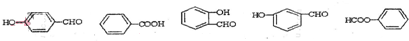 .
.