题目内容
19. 金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )
金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( )| A. | 绿原酸能与FeCl3发生显色反应 | |
| B. | 1个绿原酸分子中含有4个手性碳原子 | |
| C. | 绿原酸与足量的NaOH反应,其中一种产物的化学式为C9H5O4Na3 | |
| D. | 1mol绿原酸最多能与6molH2发生反应 |
分析 由结构可知分子式,分子中含酚-OH、碳碳双键、-COOC-、-COOH、-OH,结合酚、烯烃、酯、羧酸、醇的性质来解答.
解答 解:A.含酚-OH,能与FeCl3发生显色反应,故A正确;
B.与醇-OH相连的3个C、与-COOC-相连的环状上的C均为手性C,共4个,故B正确;
C.含-COOH、-COOC-、酚-OH均与NaOH反应,则与足量的NaOH反应,其中一种产物含苯环的化学式为C9H5O4Na3,故C正确;
D.只有碳碳双键与苯环与氢气发生加成反应,则1mol绿原酸最多能与4molH2发生反应,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质及手性碳的判断,题目难度不大.

练习册系列答案
相关题目
10.等物质的量的NaCl、MgCl2两种固体,其中Cl-的物质的量之比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 3:1 |
4.下列除去杂质的方法不正确的是( )
| A. | 除去甲烷中少量的乙烯:气体通过溴水溶液的洗气瓶 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠氢溶液的洗气瓶 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 |
11.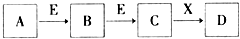 中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )
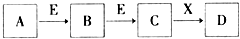 中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )| A. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| B. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| C. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 通常情况下,32gO2和O3的混合气体含有的分子总数小于NA | |
| B. | 常温常压下,0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| C. | 1mol有机物 中最多有6NA个原子在一条直线上 中最多有6NA个原子在一条直线上 | |
| D. | 1mol甲基 所含的电子数为7NA 所含的电子数为7NA |
9.下列图示与对应的叙述相符的是( )
| A. | 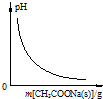 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 | |
| B. | 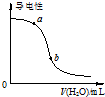 图表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b | |
| C. | 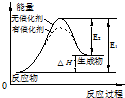 图表示催化剂能改变化学反应的焓变 | |
| D. | 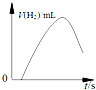 图表示表面有氧化膜的镁条投入稀盐酸中产生氢气的速率随时间的变化曲线 |
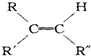 $→_{②Zn/H_{2}O}^{①O_{3}}$
$→_{②Zn/H_{2}O}^{①O_{3}}$ +
+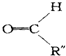 .
.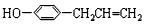 ,C
,C ,E
,E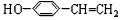 .
.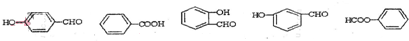 .
.