题目内容
某液体化合物X2Y4,常用做火箭燃料.16g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)═X2(g)+2Y2O(l).冷却后标准状况下测得生成物的体积为11.2L,其密度为1.25g?L-1,则:
(1)反应前O2的体积V(O2)为 ;
(2)X2的摩尔质量为 ;Y元素的名称是 .
(1)反应前O2的体积V(O2)为
(2)X2的摩尔质量为
考点:化学方程式的有关计算
专题:计算题
分析:(1)由方程式可知,反应前后气体的体积不发生变化,据此计算氧气的体积;
(2)标准状况下,气体摩尔质量M=Vm×ρ,据此计算气体X2的摩尔质量;根据方程式计算的物质的量X2Y4,再计算X2Y4的相对分子质量,进而计算Y的相对原子质量,确定Y元素名称.
(2)标准状况下,气体摩尔质量M=Vm×ρ,据此计算气体X2的摩尔质量;根据方程式计算的物质的量X2Y4,再计算X2Y4的相对分子质量,进而计算Y的相对原子质量,确定Y元素名称.
解答:
解:(1)由方程式可知,反应前后气体的体积不发生变化,X2和氧气的关系式为1:1,故V(O2)=V(X2)=11.2L,
故答案为:11.2L;
(2)标准状况下,气体摩尔质量M=Vm×ρ,气体X2的摩尔质量=22.4L/mol×1.25g/L=28g/mol,
11.2L X2的物质的量=
=0.5mol,n(X2Y4)=n(X2)=0.5mol,故Mr(X2Y4)=
=32,则Y的相对原子质量=
=1,故Y为氢元素,
故答案为:28g/mol;氢.
故答案为:11.2L;
(2)标准状况下,气体摩尔质量M=Vm×ρ,气体X2的摩尔质量=22.4L/mol×1.25g/L=28g/mol,
11.2L X2的物质的量=
| 11.2L |
| 22.4L/mol |
| 16 |
| 0.5 |
| 32-28 |
| 4 |
故答案为:28g/mol;氢.
点评:本题考查化学方程式的有关计算,难度不大,注意根据方程式的特征计算氧气的体积,理解气体的摩尔质量与密度的关系.

练习册系列答案
相关题目
质量分数2w,物质的量浓度为c1的H2SO4溶液加水稀释后,质量分数变为w,物质的量浓度变为c2,则c1( ) 2c2.
| A、大于 | B、小于 |
| C、等于 | D、无法确定 |
下列离子方程式中,正确的是( )
| A、将Na2O2固体投入H218O中:2H218O+2Na2O2=4OH-+4Na++18O2↑ |
| B、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:2AlO2-+5 H+═Al(OH)3↓+Al3++H2O |
| C、碳酸氢钠溶液与少量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |

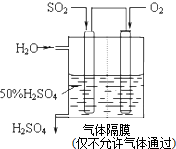
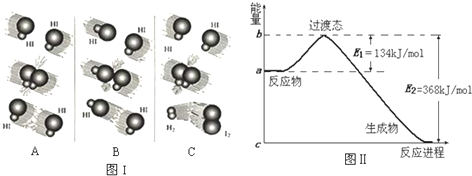
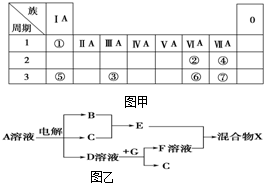 如图甲为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
如图甲为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题: