题目内容
质量分数2w,物质的量浓度为c1的H2SO4溶液加水稀释后,质量分数变为w,物质的量浓度变为c2,则c1( ) 2c2.
| A、大于 | B、小于 |
| C、等于 | D、无法确定 |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:浓硫酸的密度大于水,硫酸溶液的浓度越大,其密度越大,利用c=
进行判断.
| 1000ρw |
| M |
解答:
解:设物质的量是浓度为c1 mol?L-1的密度为ρ1,物质的量是浓度为c2mol?L-1硫酸溶液的密度为ρ2,则:
c1=
,c2=
,所以,
=
,因硫酸溶液的浓度越大,其密度越大,则ρ1>ρ2,则c1>2c2,
故选A.
c1=
| 1000ρ1×2w |
| 98 |
| 1000ρ2w |
| 98 |
| C1 |
| C2 |
| 2ρ1 |
| ρ2 |
故选A.
点评:本题考查物质的量浓度与质量分数的关系计算,题目难度中等,注意浓硫酸的密度大于水,硫酸溶液的浓度越大密度越大,注意中学常见浓度越大密度越小的溶液有氨水、酒精溶液等.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
为达到下表所列的实验目的,所采用的实验方法正确、可靠的是( )
| 实验目的 | 实验方法 | |
| A | 检验某混合溶液中是否有Cl- | 取样滴加AgNO3溶液 |
| B | 除去食盐中的少量氯化铵 | 加热 |
| C | 鉴别乙烷和乙烯 | 分别通入溴水 |
| D | 证明某地雨水样品呈酸性 | 取样滴入酚酞 |
| A、A | B、B | C、C | D、D |
某合作学习小组讨论辨析:①生活中使用的漂白粉和肥皂都是混合物;②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物;③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质;④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物;⑤水玻璃、有色玻璃和果冻都是胶体;⑥汽油属于混合物,而液氯、冰醋酸均属于纯净物;⑦烟、雾、豆浆都是胶体.上述说法正确的是( )
| A、①②④⑥⑦ | B、③④⑤⑥ |
| C、②④⑤⑦ | D、①②③⑤⑦ |
已知:2CO(g)+O2═2CO2(g)△H═-566kj?mol-1
Na2O2(s)+CO2═Na2Co3(s)+
△H═-266kJ?mol-1
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2═Na2Co3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为283kJ |
B、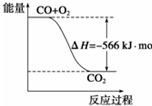 可表示有CO生成CO2的反应过程和能量关系 |
| C、Na2O2(s)+2CO2═Na2Co3(s)+O2(g)△H>-532kJ?mol-1 |
| D、CO(g)与Na2O2(s)反应放出549kJ热量时,电子转移数为6.02×1023 |
下列说法错误的是( )
| A、石油分馏时温度计水银球位置处在蒸馏烧瓶的支管口附近 |
| B、5mL 10%硫酸铜溶液中滴入5滴5%氢氧化钠溶液,再加入1mL葡萄糖溶液,加热,可观察到砖红色沉淀 |
| C、在乙醇中加入钠可产生氢气 |
| D、浓HNO3应保存在棕色试剂瓶中,并贮存在避光、低温处 |
下列无色溶液中都能大量共存的离子组是( )
| A、K+、CO32-、Ag+、SO42- |
| B、Na+、Cu2+、SO42-、Cl- |
| C、NO3-、Na+、MnO4-、K+ |
| D、Ca2+、K+、Cl-、NO3- |
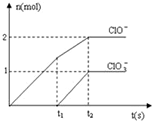 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、ClO
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、ClO- 3 |
- 3 |
| A、0~t1时,Ca(OH)2与Cl2发生反应的总化学方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O | ||
B、t2时,Cl-与ClO
| ||
| C、该石灰乳中含有Ca(OH)2的物质的量为10mol | ||
| D、由图可知,生成Ca(ClO3)2的反应是由温度升高引起的 |
在相同温度下,等体积等物质的量浓度的4种稀溶液:①Na2SO4、②H2S、③NaHSO3、④Na2S中所含带电微粒数由多到少的顺序是( )
| A、①=④>③=② |
| B、④=①>③>② |
| C、①>④>③>② |
| D、④>①>③>② |