题目内容
将6molH2和3molCO充入容积为0.5L的密闭容器中,进行如下反应:2H2(气)+CO(气)?CH3OH(气),6秒末时容器内压强为开始时的0.6倍.
试计算:
(1)H2的反应速率是多少?
(2)CO的转化率为多少?
试计算:
(1)H2的反应速率是多少?
(2)CO的转化率为多少?
考点:化学平衡的计算
专题:化学平衡专题
分析:根据压强之比等于物质的量之比,结合方程式利用三段式法计算相关物理量,反应速率=
,转化率=
×100%.
| △c |
| △t |
| 消耗量 |
| 起始量 |
解答:
解:设平衡时转化的CO的物质的量为n,则
2H2(气)+CO(气)?CH3OH(气)
起始(mol):6mol 3mol 0
转化(mol):2n n n
平衡(mol):(6mol-2n) (3mol-n) n
反应后气体的总物质的量为(6mol-2n)+(3mol-n)+n=9mol-2n
压强之比等于物质的量之比,
则
=0.6,n=1.8mol,则
①(1)(H2)=
=1.2mol?L-1?s-1,答:H2的反应速率是1.2mol?L-1?s-1;
(2)CO的转化率为
×100%=60%,答:CO的转化率为60%.
2H2(气)+CO(气)?CH3OH(气)
起始(mol):6mol 3mol 0
转化(mol):2n n n
平衡(mol):(6mol-2n) (3mol-n) n
反应后气体的总物质的量为(6mol-2n)+(3mol-n)+n=9mol-2n
压强之比等于物质的量之比,
则
| 9mol-2n |
| 9mol |
①(1)(H2)=
| ||
| 6s |
(2)CO的转化率为
| 1.8mol |
| 3mol |
点评:本题考查化学平衡的计算,题目难度中等,注意反应速率和转化率概念的计算应用,题目较简单.

练习册系列答案
相关题目
已知:2CO(g)+O2═2CO2(g)△H═-566kj?mol-1
Na2O2(s)+CO2═Na2Co3(s)+
△H═-266kJ?mol-1
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2═Na2Co3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为283kJ |
B、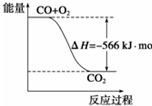 可表示有CO生成CO2的反应过程和能量关系 |
| C、Na2O2(s)+2CO2═Na2Co3(s)+O2(g)△H>-532kJ?mol-1 |
| D、CO(g)与Na2O2(s)反应放出549kJ热量时,电子转移数为6.02×1023 |
在相同温度下,等体积等物质的量浓度的4种稀溶液:①Na2SO4、②H2S、③NaHSO3、④Na2S中所含带电微粒数由多到少的顺序是( )
| A、①=④>③=② |
| B、④=①>③>② |
| C、①>④>③>② |
| D、④>①>③>② |
向2.5mL 0.2mol/L的Na2CO3溶液中慢慢加入0.1mol/L的盐酸7.5mL,在标况下产生CO2气体的体积是( )
| A、8.4 mL |
| B、5.6 mL |
| C、4.2 mL |
| D、2.8 mL |