题目内容
1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞.
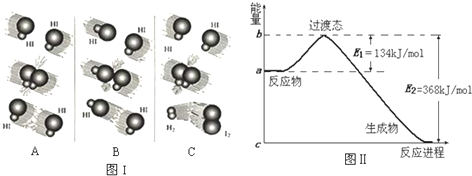
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是 (选填“A”、“B”或“C”);
(2)图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;E1的大小对该反应的反应热有无影响 (填“有”或“无”)
(3)请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
(4)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
已知:反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H=-106kJ/mol,则上表中X= .

(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
(2)图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(3)请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
(4)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ?mol-1 | X | 243 | 330 | 432 |
考点:反应热和焓变,热化学方程式
专题:化学反应中的能量变化
分析:(1)根据活化分子发生有效碰撞时发生化学反应进行判断;
(2)反应物总能量大于生成物总能量,应为放热反应,反应热为134kJ/mol-368kJ/mol=-234kJ/mol,反应热的大小决定于反应物和生成物能量高低;
(3)E1是反应的活化能不影响反应的反应热;
(4)依据反应焓变△H=反应物键能总和-生成物键能总和计算得到.
(2)反应物总能量大于生成物总能量,应为放热反应,反应热为134kJ/mol-368kJ/mol=-234kJ/mol,反应热的大小决定于反应物和生成物能量高低;
(3)E1是反应的活化能不影响反应的反应热;
(4)依据反应焓变△H=反应物键能总和-生成物键能总和计算得到.
解答:
解:(1)只有发生化学反应的碰撞才是有效碰撞,分析三个图,可知只有C有新物质生成,则C为有效碰撞,故答案为:C;
(2)反应热为134kJ/mol-368kJ/mol=-234kJ/mol,则反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol,反应热的大小与生成物的活化能无关,决定于反应物和生成物的能量差,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol;无;
(3)E1是反应的活化能,反应焓变是和反应物和生成物有关于反应过程无关,不影响反应的反应热,故答案为: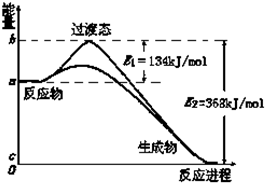 ;
;
(4)反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H=-106kJ/mol,反应焓变△H=4×C-H+Cl-Cl-(C-Cl+3×C-H+H-Cl)=-106,
4X+243-(330+3X+432)=-106计算得到X=413kJ/mol;
故答案为:413.
(2)反应热为134kJ/mol-368kJ/mol=-234kJ/mol,则反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol,反应热的大小与生成物的活化能无关,决定于反应物和生成物的能量差,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol;无;
(3)E1是反应的活化能,反应焓变是和反应物和生成物有关于反应过程无关,不影响反应的反应热,故答案为:
 ;
;(4)反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H=-106kJ/mol,反应焓变△H=4×C-H+Cl-Cl-(C-Cl+3×C-H+H-Cl)=-106,
4X+243-(330+3X+432)=-106计算得到X=413kJ/mol;
故答案为:413.
点评:本题考查了化学反应有效碰撞的含义和活化能的表示意义,依据键能计算反应焓变的方法是解题关键,题目难度中等.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目
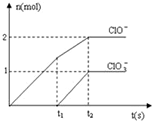 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、ClO
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、ClO- 3 |
- 3 |
| A、0~t1时,Ca(OH)2与Cl2发生反应的总化学方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O | ||
B、t2时,Cl-与ClO
| ||
| C、该石灰乳中含有Ca(OH)2的物质的量为10mol | ||
| D、由图可知,生成Ca(ClO3)2的反应是由温度升高引起的 |
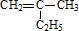 的键线式
的键线式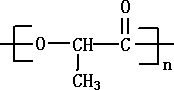 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为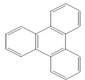 的一氯取代物有
的一氯取代物有
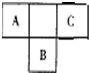 短周期元素的A、B、C在元素周期表中的位置如右图所示,已知A、C 两种元素的原子核外电子数之和等于B的质子数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如右图所示,已知A、C 两种元素的原子核外电子数之和等于B的质子数,B原子核内质子数和中子数相等.据此填空: