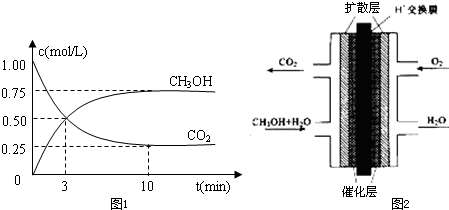
题目内容
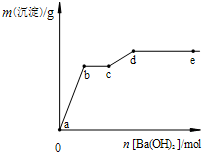 在含有4mol HCl和1mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法正确的是( )
在含有4mol HCl和1mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法正确的是( )| A、a→b时的沉淀的成分为BaSO4与Mg(OH)2 |
| B、b→c时发生的离子反应为:H++OH-→H2O |
| C、c→d时离子的物质的量:Ba2+可能大于Cl- |
| D、d→e时离子的物质的量:Ba2+一定大于OH- |
考点:离子方程式的书写
专题:离子反应专题
分析:向含有4mol HCl和1mol MgSO4的混合溶液中加入Ba(OH)2溶液后,4mol氯化氢能够消耗2mol氢氧化钡,即氢离子完全反应时溶液中含有钡离子2mol;而1mol硫酸镁中含有1mol硫酸根离子,完全转化成硫酸钡沉淀需要消耗1mol氢氧化钡,说明加入1mol氢氧化钡时,硫酸根离子完全沉淀,由于溶液中存在氢离子,此时不会生成氢氧化镁沉淀,发生反应的是氢离子与氢氧根离子反应,所以沉淀的质量暂时不变,当加入的氢氧化钡大于2mol后,氢离子完全反应,镁离子开始与氢氧根离子反应生成氢氧化镁沉淀,当加入3mol氢氧化钡后,沉淀的质量达到最大,据此进行解答.
解答:
解:由题意可知:向含有4mol HCl和1mol MgSO4的混合溶液中加入Ba(OH)2溶液后,4mol氯化氢能够消耗2mol氢氧化钡,即氢离子完全反应时溶液中含有钡离子2mol;而1mol硫酸镁中含有1mol硫酸根离子,完全转化成硫酸钡沉淀需要消耗1mol氢氧化钡,说明加入1mol氢氧化钡时,硫酸根离子完全沉淀,由于溶液中存在氢离子,此时不会生成氢氧化镁沉淀,发生反应的是氢离子与氢氧根离子反应,所以沉淀的质量暂时不变,当加入的氢氧化钡大于2mol后,氢离子完全反应,镁离子与氢氧根离子反应生成氢氧化镁沉淀,
A.根据分析可知,a→b段产生的沉淀只有BaSO4,由于HCl的存在,OH-不能与Mg2+产生沉淀Mg(OH)2,故A错误;
B.b→c段表示的是氢离子与氢氧根离子反应生成水,反应的离子方程式为:H++OH-→H2O,故B正确;
C.c→d时,氯离子的物质的量不变,就是4mol;在b点加入的1mol氢氧化钡中钡离子完全生成硫酸钡沉淀,在c点氢离子恰好反应,加入了2mol氢氧化钡,而溶液中只有1mol钡离子;c→d生成氢氧化镁沉淀,溶液中含有1mol镁离子,需要加入1mol氢氧化钡,所以既是在d点,溶液中钡离子的物质的量只有2mol
,离子的物质的量:Ba2+一定小于Cl-,故C错误;
D.d→e时,由于加入的氢氧化钡的物质的量不确定,根据氢氧化钡的化学式可知,溶液中离子的物质的量:Ba2+可能小于OH-,有可能大于氢氧根离子,故D错误;
故选B.
A.根据分析可知,a→b段产生的沉淀只有BaSO4,由于HCl的存在,OH-不能与Mg2+产生沉淀Mg(OH)2,故A错误;
B.b→c段表示的是氢离子与氢氧根离子反应生成水,反应的离子方程式为:H++OH-→H2O,故B正确;
C.c→d时,氯离子的物质的量不变,就是4mol;在b点加入的1mol氢氧化钡中钡离子完全生成硫酸钡沉淀,在c点氢离子恰好反应,加入了2mol氢氧化钡,而溶液中只有1mol钡离子;c→d生成氢氧化镁沉淀,溶液中含有1mol镁离子,需要加入1mol氢氧化钡,所以既是在d点,溶液中钡离子的物质的量只有2mol
,离子的物质的量:Ba2+一定小于Cl-,故C错误;
D.d→e时,由于加入的氢氧化钡的物质的量不确定,根据氢氧化钡的化学式可知,溶液中离子的物质的量:Ba2+可能小于OH-,有可能大于氢氧根离子,故D错误;
故选B.
点评:本题考查了离子反应,题目难度中等,在根据物质的性质对表示变化过程的曲线进行分析时,要特别关注曲线的起点、折点及趋势的特殊意义;注意明确各点表示的意义.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
弱电解质区别于强电解质的理论根据是( )
| A、溶液的导电性差 |
| B、在溶液中离子与离子间存在电离平衡 |
| C、溶解度小 |
| D、在溶液中存在分子和离子之间的电离平衡 |
NA代表阿伏加德常数,下列说法中,正确的是( )
| A、在同温同压时,相同体积的任何气体单质所含的原子数目相同 |
| B、2 g氢气所含原子数目为NA |
| C、在常温常压下,11.2 L氮气所含的原子数目为NA |
| D、17 g氨气所含电子数目为10 NA |
地壳中化学元素含量前四为排序正确的是( )
| A、氧、硅、铁、铝 |
| B、铁、氧、铝、镁 |
| C、氧、硅、铝、铁 |
| D、硅、氧、铝、铁 |
NA表示阿佛加德罗常数,下列说法正确的是( )
| A、60克SiO2含有2NA个Si-O共价键 |
| B、1.0L 1.0mo1/L的NaAlO2水溶液中含有的氧原子数为2NA |
| C、8.2g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA |
| D、NA个Fe(OH)3胶体粒子的质量为107g |
滴有酚酞和氯化钠试液的湿润滤纸分别做甲乙两个实验,能发现附近变成红色的电极是( )


| A、a、c | B、b、d |
| C、a、d | D、b、c |
H2SO3水溶液中存在电离平衡H2SO3?H++HSO3-和HSO3-?H++SO32-,若向H2SO3溶液中( )
| A、通入氯气,溶液中氢离子浓度增大 |
| B、通入过量H2S,反应后溶液pH减小 |
| C、加入氢氧化钠溶液,平衡向右移动,pH变小 |
| D、加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀 |
25℃时,水的电离达到平衡;H2O?H-+OH-△H>0,下列叙述正确的是( )
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H-)降低 |
| C、向水中加入少量固体氢氧化钠,平衡正向移动,c(H-)降低 |
| D、将水加热,KW增大,pH不变 |