题目内容
2.写出下列物质的电子式,在括号内指出所含化学键的类型.(1)NH4Cl:
 ,离子键,共价键;
,离子键,共价键;(2)NaOH:
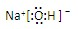 ,离子键,共价键;
,离子键,共价键;(3)H2O2:
 ;共价键;
;共价键;(4)Na2O2:
 ,共价键,离子键.
,共价键,离子键.(5)CO2:
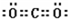 ;共价键;
;共价键;(6)CCl4:
 ;共价键.
;共价键.
分析 (1)氯化铵为离子化合物,复杂阳离子和阴离子均需要加括号和电荷;
(2)氢氧化钠为离子化合物,钠离子与氢氧根离子存在离子键,氢氧根离子中氧原子和氢原子存在共价键,电子式中需要标出阴阳离子所带电荷;
(3)双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(4)过氧化钠为含有非极性共价键的离子化合物;
(5)二氧化碳分子中每个氧原子和碳原子形成两个共用电子对,每个氧原子含有2个孤电子对;
(6)CCl4为共价化合物,各原子满足8电子稳定结构.
解答 解:(1)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,含有离子键和共价键;
,含有离子键和共价键;
故答案为: ;离子键,共价键;
;离子键,共价键;
(2)氢氧化钠中存在钠离子和氢氧根离子,电子式需要标出阴阳离子所带电荷,氢氧化钠的电子式为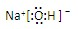 ,钠离子与氢氧根离子存在离子键,氢氧根离子中氧原子和氢原子存在共价键;
,钠离子与氢氧根离子存在离子键,氢氧根离子中氧原子和氢原子存在共价键;
故答案为: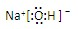 ,离子键,共价键;
,离子键,共价键;
(3)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,分子中含有共价键;
,分子中含有共价键;
故答案为: ;共价键;
;共价键;
(4)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,含有共价键和离子键,
,含有共价键和离子键,
故答案为: ;共价键和离子键;
;共价键和离子键;
(5)二氧化碳分子中每个氧原子和碳原子形成两个共用电子对,每个氧原子含有2个孤电子对,二氧化碳分子的电子式为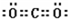 ;
;
故答案为: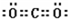 ;共价键;
;共价键;
(6)CCl4为共价化合物,各原子满足8电子稳定结构,电子式为
故答案为:
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
相关题目
10.下列说法不正确的是( )
| A. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| B. | Ksp只与难溶电解质的性质和温度有关 | |
| C. | 其他条件不变,离子浓度改变时,Ksp不变 | |
| D. | 两种难溶电解质,Ksp小的,溶解度一定小 |
17.25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-amol/L,下列说法正确的是( )
| A. | a<7时,水的电离受到抑制 | B. | a>7时,水的电离受到抑制 | ||
| C. | a<7时,溶液的pH一定为a | D. | a>7时,溶液的pH一定为14-a |
7.下列关于酒精的说法,正确的是( )
| A. | 难挥发 | B. | 不能与水互溶 | C. | 能燃烧 | D. | 不能和乙酸反应 |
14.同主族3种元素X、Y、Z,已知它们的最高价氧化物对应水化物的酸性HXO4>HYO4>HZO4,则下列判断正确的是( )
| A. | 原子半径X>Y>Z | B. | 气态氢化物稳定性 HX<HY<HZ | ||
| C. | 非金属性X>Y>Z | D. | 阴离子的还原性X->Y->Z- |
11.“抓好资源节约,建设环境友好型社会”,是我国社会和经济长期发展的重要保证.你认为下列做法与之不相符的是( )
| A. | 推广使用乙醇汽油作汽车燃料 | |
| B. | 研制开发以水代替有机溶剂的化工涂料 | |
| C. | 农村大力发展沼气,将废弃的秸杆转化为清洁高效的能源 | |
| D. | 包装盒、快餐盒等全部用聚苯乙烯生产,以减少木材的使用 |
12.能正确表示下列反应离子方程式的是( )
| A. | CuCl2溶液中加入少量氨水:Cu2++2OH-═Cu(OH)2↓ | |
| B. | 向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-═2MnO2↓+3SO42-+2H2O | |
| C. | 向CuSO4溶液中加Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
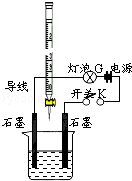 有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.
有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.