题目内容
7.下列关于酒精的说法,正确的是( )| A. | 难挥发 | B. | 不能与水互溶 | C. | 能燃烧 | D. | 不能和乙酸反应 |
分析 乙醇为无色液体,易溶于水,沸点低,易挥发,含有-OH,可发生氧化、取代、和消去反应,以此解答该题.
解答 解:A.乙醇沸点低,易挥发,故A错误;
B.乙醇易溶于水,故B错误;
C.乙醇可作燃料,能燃烧,故C正确;
D.乙醇可以与乙酸反应发生酯化反应生成乙酸乙酯,故D错误.
故选C.
点评 本题考查有机物的结构和性质,注重于乙醇的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
12.某化学课外小组为了探究AgNO3溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知Ag2SO4在水中微溶,AgCl在水中难溶)
| 实验步骤 | 向3-4mL 1mol/L AgNO3溶液中滴入1mol/L的Na2SO4溶液至反应完全. |
| 实验现象 | ①产生白色沉淀 |
| 离子方程式 | 2Ag++SO${\;}_{4}^{2-}$=Ag2SO4 |
| 小组讨论交流 | 取上述反应后的清液于试管中滴入适量1mol/L的NaCl 溶液,对于会出现的现象提出了假设 |
| 提出假设 | 假设Ⅰ:反应没有限度 假设Ⅱ:②无现象 |
| 证明假设Ⅱ | 现象③:产生白色沉淀;理由④反应存在限度,溶液中尚有较多Ag+ |
| 离子方程式 | ⑤Ag++Cl-=AgCl↓ |
| 解释 | ⑥加入Cl-产生了大量的白色沉淀,说明Ag++Cl- AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 |
19.氮的氢化物NH3和N2H4有广泛应用.
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol•L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为 (用化学式表示)Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2.
(2)实验室制备氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应.以石墨为电极,将该反应设计成原电池,该电池的负极反应为2NH3+2OH--2e-═N2H4+2H2O.
(3)在3L密闭容器中,起始投入4molN2和9molH2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
已知:破坏1molN2(g)和3molH2(g)中的化学键消耗的总能量小于破坏2molNH3(g)中的化学键消耗的能量.
①则T1<T2(填“>”、“<”或“=”)
②在T2K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=0.1 mol•L-1•min-1,平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”)
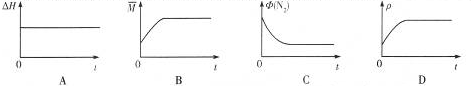
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量( $\overline{M}$)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是BC.
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
(2)实验室制备氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应.以石墨为电极,将该反应设计成原电池,该电池的负极反应为2NH3+2OH--2e-═N2H4+2H2O.
(3)在3L密闭容器中,起始投入4molN2和9molH2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1<T2(填“>”、“<”或“=”)
②在T2K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=0.1 mol•L-1•min-1,平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”)
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量( $\overline{M}$)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是BC.

16.键线式可以简明扼要的表示碳氢化合物的结构,键线式为  的物质名称是( )
的物质名称是( )
 的物质名称是( )
的物质名称是( )| A. | 丙烯 | B. | 2-丁烯 | C. | 1-丁烯 | D. | 丁烷 |
17.下列反应中,生成的有机物只有一种的是( )
| A. | 异戊二烯(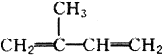 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(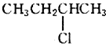 )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 | |
| D. | 新戊烷和氯气发生取代反应生成一氯取代物的反应 |

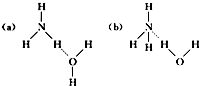
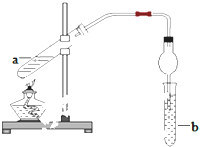 如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验. CH3COOC2H5+H2O.
CH3COOC2H5+H2O. ,离子键,共价键;
,离子键,共价键;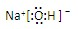 ,离子键,共价键;
,离子键,共价键; ;共价键;
;共价键; ,共价键,离子键.
,共价键,离子键.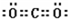 ;共价键;
;共价键; ;共价键.
;共价键.