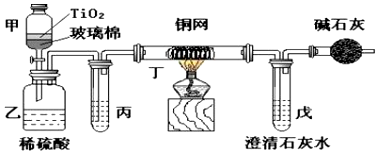
题目内容
14.关于溶液的pH值,下列说法正确的是( )| A. | pH=0的溶液呈中性 | |
| B. | 某强碱溶液的浓度为0.01 mol/L,该溶液的pH值一定为12 | |
| C. | 溶液pH值越大,氢离子浓度越大 | |
| D. | 酸性溶液中,氢离子浓度一定大于氢氧根浓度 |
分析 A.pH=0的溶液呈酸性;
B.强碱溶液中溶质不一定为一元强碱;
C.氢离子浓度和氢氧根离子浓度乘积为常数,离子浓度为小于1的浓度;
D.溶液酸碱性取决于溶液中氢离子浓度和氢氧根离子浓度的相对大小.
解答 解:A.pH=0的溶液中氢离子浓度为1mol/L,溶液呈酸性,故A错误;
B.某强碱溶液的浓度为0.01 mol/L,若为一元碱则溶液PH=12,但若为二元碱氢氧根离子浓度为0.02mol/L,溶液PH不是12,所以某强碱溶液的浓度为0.01 mol/L,该溶液的pH值不一定为12,故B错误;
C.溶液pH值越大,氢氧根离子浓度越大,氢离子浓度越小,故C错误;
D.氢离子浓度大于氢氧根浓度,溶液显酸性,故D正确;
故选D.
点评 本题考查了溶液酸碱性的判断方法、溶液PH的计算、注意溶质成分,掌握基础是解题关键,题目难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
5.下列关于氢化物的叙述正确的是( )
| A. | 沸点:H2S>HF | B. | 稳定性:H2S<HF | ||
| C. | 一个D2O分子中所含的中子数为8 | D. | HCl的电子式为H+[:Cl:]- |
2.下列有关17O的说法正确的是??( )
| A. | 质子数为8 | B. | 中子数为8 | C. | 核外电子数为17 | D. | 原子序数为17 |
9.检验SO2中是否含有CO2应采用的方法有( )
| A. | 通过石灰水 | |
| B. | 通过品红溶液 | |
| C. | 先通过小苏打溶液,再通过石灰水 | |
| D. | 先通过足量溴水溶液,再通过石灰水 |
6. 将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.
将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.
①一定有C2H4
②一定有CH4
③一定有C3H8
④一定没有C2H6
⑤可能有C2H2
⑥可能有C3H4
则上述对该混合烃的判断正确的是( )
 将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.
将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.①一定有C2H4
②一定有CH4
③一定有C3H8
④一定没有C2H6
⑤可能有C2H2
⑥可能有C3H4
则上述对该混合烃的判断正确的是( )
| A. | ②③⑤ | B. | ⑤⑥ | C. | ②④⑥ | D. | ①④ |
3.下面的排序不正确的是( )
| A. | 晶体熔点的高低: > > | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
8. (1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
H2(g)═H2(l),△H=-0.92kJ/mol
O2(g)═O2(l),△H=-6.84kJ/mol
请写出液氢和液氧生成气态水的热化学方程式H2(l)+$\frac{1}{2}$O2(l)=H2O(g)△H=-237.46KJ/mol
(2)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,正极发生的电极反应式为O2+4e-+2H2O=4OH-.
(3)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2(g)+O2(g)?2N2O5(g)
已知体系中n(NO2)随时间变化如表:
①写出该反应的平衡常数表达式:K=$\frac{{C}^{2}({N}_{2}{O}_{5})}{{C}^{4}(N{O}_{2})×C({O}_{2})}$,已知:K300℃>K350℃,则该反应是放热反应
②达到平衡后,NO2的转化率为49.6%,此时若再通入量氮气,则NO2的转化率将不变(填“增大”、“减小”、“不变”);
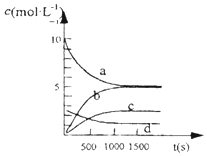
③右图中表示N2O5的浓度的变化曲线是c;
用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol/(L•s).
 (1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/molH2(g)═H2(l),△H=-0.92kJ/mol
O2(g)═O2(l),△H=-6.84kJ/mol
请写出液氢和液氧生成气态水的热化学方程式H2(l)+$\frac{1}{2}$O2(l)=H2O(g)△H=-237.46KJ/mol
(2)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,正极发生的电极反应式为O2+4e-+2H2O=4OH-.
(3)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2(g)+O2(g)?2N2O5(g)
已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(ml) | 20 | 13.96 | 10.08 | 10.08 |
②达到平衡后,NO2的转化率为49.6%,此时若再通入量氮气,则NO2的转化率将不变(填“增大”、“减小”、“不变”);
③右图中表示N2O5的浓度的变化曲线是c;
用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol/(L•s).