题目内容
2.下列有关17O的说法正确的是??( )| A. | 质子数为8 | B. | 中子数为8 | C. | 核外电子数为17 | D. | 原子序数为17 |
分析 原子符号左上角为质量数,原子中原子序数=核电荷数=质子数=核外电子数,质量数=质子数+中子数,据此分析计算.
解答 解:A.17O质子数为8,故A正确;
B.17O中子数=17-8=9,故B错误;
C.核外电子数为核内质子数为8,故C错误;
D.氧元素原子序数为8,故D错误;
故选A.
点评 本题考查了原子结构、原子构成关系、微粒之间的定量关系,掌握基础是解题关键,题目难度不大.

练习册系列答案
 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
12.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景.
(1)已知:CH3OH(g)═HCHO(g)+H2(g)△H=+84kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316kJ•mol-1.
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)?CH3OH(g),已知某些化学键的键能数据如表:
请回答下列问题:
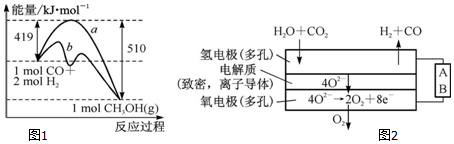
①该反应的△S<(填“>”或“<”)0.图1中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为x kJ•mol-1,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
②若以该电池为电源,用石墨作电极电解200mL含有如表离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为3.2g.
(4)电解水蒸气和CO2产生合成气(H2+CO).较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由图2可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
(1)已知:CH3OH(g)═HCHO(g)+H2(g)△H=+84kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316kJ•mol-1.
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)?CH3OH(g),已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |

①该反应的△S<(填“>”或“<”)0.图1中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为x kJ•mol-1,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
②若以该电池为电源,用石墨作电极电解200mL含有如表离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
(4)电解水蒸气和CO2产生合成气(H2+CO).较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由图2可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
10.下列有关化合物的说法正确的是( )
| A. | 明矾的主要成分是氢氧化铝 | B. | CH3OH可导致人体中毒 | ||
| C. | SO2可大量用于漂白食品 | D. | Na2CO3可以做胃药 |
17.下列实验过程中,溶液的pH大于7的是( )
| A. | 向KNO3溶液中滴加醋酸 | B. | 向KNO3溶液中滴加稀H2SO4 | ||
| C. | 向稀NaCl溶液中滴加稀HNO3 | D. | 向NaCl溶液中滴加Na2CO3溶液 |
7.黑火药是我国古代四大发明之一,下列物质中不是黑火药主要成分的是( )
| A. | 硫磺 | B. | 硝酸铵 | C. | 硝酸钾 | D. | 木炭 |
14.关于溶液的pH值,下列说法正确的是( )
| A. | pH=0的溶液呈中性 | |
| B. | 某强碱溶液的浓度为0.01 mol/L,该溶液的pH值一定为12 | |
| C. | 溶液pH值越大,氢离子浓度越大 | |
| D. | 酸性溶液中,氢离子浓度一定大于氢氧根浓度 |
11.以下说法不正确的是( )
| A. | 乙醇不能与NaOH溶液反应,苯酚可以与NaOH溶液反应,说明苯环对羟基产生影响 | |
| B. | 苯不能被酸性KMnO4溶液氧化,甲苯可以被酸性KMnO4溶液氧化为苯甲酸,说明侧链对苯环产生了影响 | |
| C. | 苯与苯酚与溴水反应的条件、产物区别,说明羟基对苯环产生影响 | |
| D. | 苯和甲苯硝化反应产物的区别,说明甲基对苯环产生影响 |
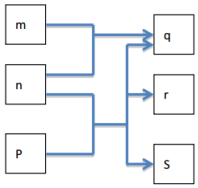 短周期元素W、X、Y、Z分别属于三个周期,其原子序数依次增大,Y的原子半径是短周期主族元素中最大的.由W、X、Y、Z组成的物质之间存在下图所示的转化关系,其中m是元素Y的单质,n是元素Z的单质,通常为黄绿色气体,s的水溶液常用作漂白剂和消毒剂.
短周期元素W、X、Y、Z分别属于三个周期,其原子序数依次增大,Y的原子半径是短周期主族元素中最大的.由W、X、Y、Z组成的物质之间存在下图所示的转化关系,其中m是元素Y的单质,n是元素Z的单质,通常为黄绿色气体,s的水溶液常用作漂白剂和消毒剂. .
.