题目内容
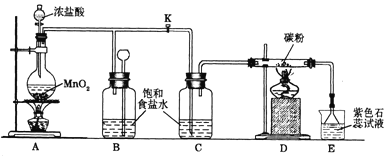
4.电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,在酸性条件下CNO-继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.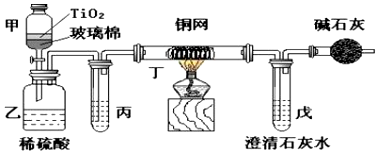
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol•L-1倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:
(1)甲中反应的离子方程式为CN-+ClO-═CNO-+Cl-,乙中反应的离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O.
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等.丙中加入的除杂试剂是饱和食盐水,其作用是除去HCl气体,丁在实验中的作用是去除Cl2,装有碱石灰的干燥管的作用是防止空气中CO2进入戊中影响测定准确度.
(3)戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82g沉淀,则该实验中测得CN-被处理的百分率等于82%.该测得值与工业实际处理的百分率相比总是偏低,简要说明可能原因之一①装置乙、丙、丁中可能滞留有CO2,②CO2产生丁速度较快未与戊中丁澄清石灰水充分反应,③Cl2、HCl在丙、丁中未吸收完全.
分析 (1)根据题意可知,甲中的反应为NaClO将CN-离子氧化成CNO-;乙中的反应为酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2.根据氧化还原反应配平;
(2)饱和食盐水除去氯化氢气体;铜网用来除去氯气;碱石灰作用是吸收空气中二氧化碳防止装置戊吸收二氧化碳产生误差;
(3)根据碳原子守恒,计算出被处理的CN-的物质的量,再利用200mL(其中CN-的浓度0.05mol/L)求出CN-被处理的百分率;处理的百分率偏低,说明反应生成二氧化碳没有完全生成碳酸钙沉淀.
解答 解:(1)根据题意可知,甲中的反应为NaClO将CN-离子氧化成CNO-,NaClO具有强氧化性,被还原为Cl-,反应离子方程式为CN-+ClO-═CNO-+Cl-;乙中的反应为酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O,
故答案为:CN-+ClO-═CNO-+Cl-;2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,饱和食盐水能够除去氯化氢杂质;铜网能够和氯气反应从而除去氯气杂质;避免空气中的二氧化碳进入戊装置造成测定数据的干扰,用碱石灰吸收二氧化碳,
故答案为:除去HCl气体;去除Cl2;防止空气中CO2进入戊中影响测定准确度;
(3)200mL(其中CN-的浓度0.05mol/L)混合液中含有的CN-的物质的量是:0.2L×0.05mol/L=0.01mol,根据碳原子守恒,增多生成0.01mol二氧化碳,所以石灰水过量,生成的碳酸钙的物质的量是:0.0082mol,反应的CN-的物质的量是0.0082mol,CN-被处理的百分率是$\frac{0.0082mol}{0.01mol}$×100%=82%;
该测得值与工业实际处理的百分率相比总是偏低,可能的原因有:①装置乙、丙、丁中可能滞留有CO2、②CO2产生丁速度较快未与戊中丁澄清石灰水充分反应、③Cl2、HCl在丙、丁中未吸收完全等;
能提高准确度的建议有:建议一:不将甲中溶液一次全部加入乙中,改为分次加入,控制CO2的产生速度;建议二:乙中瓶塞改为三孔塞,增加丁那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多到与Ca(OH)2反应.建议三:将戊中澄清石灰水改为浓度较大到NaOH溶液,反应结束后戊中加入足量CaCl2后测沉淀质量等,
故答案为:82%;①装置乙、丙、丁中可能滞留有CO2,②CO2产生丁速度较快未与戊中丁澄清石灰水充分反应,③Cl2、HCl在丙、丁中未吸收完全.
点评 本题考查了电镀后的废水中CN-离子的含量测定,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

| A. | 甲烷与氯气反应:CH4+Cl2$\stackrel{高温}{→}$CH3Cl+HC1(加成反应) | |
| B. | 乙烯与水在一定条件下生成乙醇:CH2=CH2+H2O$→_{一定条件}^{催化剂}$C3CH2OH(加成反应) | |
| C. | 麦芽糖制葡萄糖:$\stackrel{{C}_{12}{H}_{22}{O}_{11}}{麦芽糖}$+H2O$\stackrel{稀硫酸}{→}$$\stackrel{2{C}_{6}{H}_{12}{O}_{6}}{葡萄糖}$(氧化反应) | |
| D. | 乙醛与银氨溶液反应:CH3CHO+2Ag(NH3)2OH$→_{△}^{水浴}$CH3COONH4+3NH3+2Ag↓+H2O(取代反应) |
| A. | Ce元素位于元素周期表第六周期第IIIB族 | |
| B. | ${\;}_{58}^{138}$Ce、${\;}_{58}^{142}$Ce是同素异形体 | |
| C. | 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2 | |
| D. | 铈的原子核外有58个电子 |
(1)已知:CH3OH(g)═HCHO(g)+H2(g)△H=+84kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316kJ•mol-1.
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)?CH3OH(g),已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |
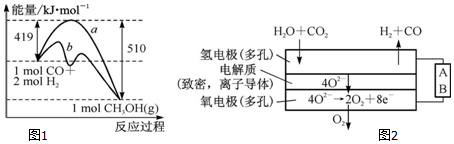
①该反应的△S<(填“>”或“<”)0.图1中曲线a到曲线b的措施是加入催化剂.
②已知CO中的C与O之间为三键,其键能为x kJ•mol-1,则x=1097.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
②若以该电池为电源,用石墨作电极电解200mL含有如表离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
(4)电解水蒸气和CO2产生合成气(H2+CO).较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由图2可知A为直流电源的负极(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:H2O+2e-=H2↑+O2-.
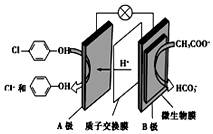 含乙酸钠和对氯酚(
含乙酸钠和对氯酚( 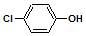 )的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )| A. | B极是电解池的负极 | |
| B. | 电子从A极沿导线经小灯泡流向B极 | |
| C. | A极的电极反应式为: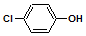 +e-═Cl-+ +e-═Cl-+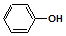 | |
| D. | 当外电路中有1 mol e-转移时,通过质子交换膜的H+为1 mol |
| A. | pH=0的溶液呈中性 | |
| B. | 某强碱溶液的浓度为0.01 mol/L,该溶液的pH值一定为12 | |
| C. | 溶液pH值越大,氢离子浓度越大 | |
| D. | 酸性溶液中,氢离子浓度一定大于氢氧根浓度 |