题目内容
8. (1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/molH2(g)═H2(l),△H=-0.92kJ/mol
O2(g)═O2(l),△H=-6.84kJ/mol
请写出液氢和液氧生成气态水的热化学方程式H2(l)+$\frac{1}{2}$O2(l)=H2O(g)△H=-237.46KJ/mol
(2)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,正极发生的电极反应式为O2+4e-+2H2O=4OH-.
(3)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:
4NO2(g)+O2(g)?2N2O5(g)
已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(ml) | 20 | 13.96 | 10.08 | 10.08 |
②达到平衡后,NO2的转化率为49.6%,此时若再通入量氮气,则NO2的转化率将不变(填“增大”、“减小”、“不变”);
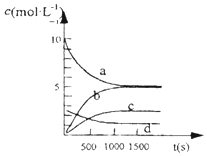
③右图中表示N2O5的浓度的变化曲线是c;
用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol/(L•s).
分析 (1)根据已知方程式构建目标方程式结合盖斯定律进行计算;
(2)燃料电池的负极是燃料失电子的氧化反应,正极上是氧气得电子的还原反应,总反应为燃烧反应,在碱性环境中氧气得电子生成氢氧根离子;
(3)①根据平衡常数表达式的书写来解答;根据升高温度平衡常数减小,说明升高温度平衡向逆反应方向移动,再根据温度对化学平衡的影响;
②根据表格可知1000S时反应达到平衡,根据转化率的公式求解;根据再通入一定量氮气,没有引起体系中4NO2(g)+O2 (g)?2N2O5(g)各物质浓度的变化;
③根据反应物的浓度在减少,生成物的浓度再增加,以及利用系数之比等于化学反应速率之比来求解;根据化学反应速率V=$\frac{△c}{△t}$,利用表格数据来求NO2的速率,然后利用系数之比等于化学反应速率之比来求O2的速率.
解答 解:(1)①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
②H2(g)═H2(l),△H=-0.92kJ/mol
③O2(g)═O2(l),△H=-6.84kJ/mol
由①-②-③×$\frac{1}{2}$得:H2(l)+$\frac{1}{2}$O2(l)=H2O(g)△H=(-241.8kJ/mol)-(-0.92kJ/mol)-(-6.84kJ/mol)×$\frac{1}{2}$=-237.46KJ/mol,
故答案为:H2(l)+$\frac{1}{2}$O2(l)=H2O(g)△H=-237.46KJ/mol;
(2)氢氧燃料电池中,H2在反应中被氧化,应从负极通入,又因为是KOH溶液,不可能生成H+,负极反应为2H2+4OH-=4H2O+4e-,正极反应为O2+2H2O+4e-=4OH-,总反应为2H2+O2=2H2O,
故答案为:O2+4e-+2H2O=4OH-;
(3)①化学平衡常数等于生成物的浓度系数次方之积除以反应物的浓度系数次方之积,所以K=$\frac{{C}^{2}({N}_{2}{O}_{5})}{{C}^{4}(N{O}_{2})×C({O}_{2})}$;升高温度平衡常数减小,说明升高温度平衡向逆反应方向移动,而升高温度平衡向吸热的方向移动,所以逆反应吸热,则正反应放热,
故答案为:$\frac{{C}^{2}({N}_{2}{O}_{5})}{{C}^{4}(N{O}_{2})×C({O}_{2})}$;放;
②根据表格可知1000S时反应达到平衡,已反应的NO2为:20mol-10.08mol=9.92mol,NO2的转化率为$\frac{9.92mol}{20mol}$×100%=49.6%;再通入一定量氮气,没有引起体系中4NO2(g)+O2 (g)?2N2O5(g)各物质浓度的变化,所以平衡不移动,转化率不变,
故答案为:49.6%;不变;
③因反应物的浓度在减少,生成物的浓度再增加,根据方程式可知O2是NO2的反应速率的$\frac{1}{4}$,N2O5和NO2的反应速率的$\frac{1}{2}$,则a为NO2的变化曲线;c为N2O5的变化曲线,d为氧气的变化曲线,0~500s内反应的平均速率v(NO2)=$\frac{\frac{20mol-13.96mol}{2L}}{500S}$=6.04×10-3mol/(L•s),v(O2)=v(NO2)×$\frac{1}{4}$=1.51×10-3mol/(L•s),
故答案为:c;1.51×10-3mol/(L•s).
点评 本题考查了热化学方程式、氢氧燃料电池、化学平衡常数、化学平衡移动、化学反应速率的计算等,题目较为综合,题目难度中等,注意盖斯定律的熟练应用以及化学平衡的有关计算,为高频考点.

| A. | pH=0的溶液呈中性 | |
| B. | 某强碱溶液的浓度为0.01 mol/L,该溶液的pH值一定为12 | |
| C. | 溶液pH值越大,氢离子浓度越大 | |
| D. | 酸性溶液中,氢离子浓度一定大于氢氧根浓度 |
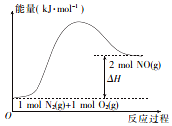 汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )
汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )| A. | 该反应是放热反应 | |
| B. | 该反应是氧化还原反应 | |
| C. | 该反应过程中有共价键的断裂和形成 | |
| D. | 使用催化剂可以改变反应速率 |
| A. | C2H5OH+3O2=2CO2+3H2O△H=-1367.0 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3 kmol-1 | |
| C. | S(s)+O2(g)=SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO(g)+O2(g)=2NO2(g)△H=-116.2 kJ |
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol•L-1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?不行.(填“行”或“不行”)
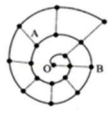 某同学在研究前 18 号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧 线上的“.”代表一种元素,其中 O 点代表氢元素.下列说法中错误的是( )
某同学在研究前 18 号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧 线上的“.”代表一种元素,其中 O 点代表氢元素.下列说法中错误的是( )| A. | B 元素是图中金属性最强的元素 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | 离 O 点越远的元素原子半径越大 | |
| D. | A、B 两种元素组成的化合物中可能含有共价键 |
| A. | 苯的结构式:C6H6 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 甲苯的分子式:C7H8 | D. | 乙醇的分子式:CH3CH2OH |
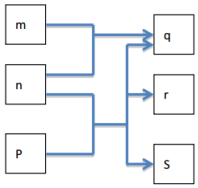 短周期元素W、X、Y、Z分别属于三个周期,其原子序数依次增大,Y的原子半径是短周期主族元素中最大的.由W、X、Y、Z组成的物质之间存在下图所示的转化关系,其中m是元素Y的单质,n是元素Z的单质,通常为黄绿色气体,s的水溶液常用作漂白剂和消毒剂.
短周期元素W、X、Y、Z分别属于三个周期,其原子序数依次增大,Y的原子半径是短周期主族元素中最大的.由W、X、Y、Z组成的物质之间存在下图所示的转化关系,其中m是元素Y的单质,n是元素Z的单质,通常为黄绿色气体,s的水溶液常用作漂白剂和消毒剂. .
.
 ,E
,E .
. ;②CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;⑥
;②CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;⑥ .H→I
.H→I $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.