题目内容
5.下列关于氢化物的叙述正确的是( )| A. | 沸点:H2S>HF | B. | 稳定性:H2S<HF | ||
| C. | 一个D2O分子中所含的中子数为8 | D. | HCl的电子式为H+[:Cl:]- |
分析 A.HF分子中存在氢键,导致氟化氢的沸点较高;
B.非金属性越强,对应氢化物稳定性越强;
C.D原子中含有1个中子,O原子中含有8个中子;
D.氯化氢为共价化合物,电子式中不能标出电荷.
解答 解:A.HF分子中存在氢键,则HF的沸点较高,故A错误;
B.非金属性越强,对应氢化物稳定性越强,非金属性F>S,则稳定性:H2S<HF,故B正确;
C.一个D2O分子所含的中子数为:2×1+8=10,故C错误;
D.HCl为共价化合物,氯化氢分子存在1对氢氯共用电子对,分子中不存在阴阳离子,氯化氢正确的电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查原子结构与周期律的关系,为高频考点,题目难度不大,侧重于基本概念的理解和运用的考查,注意把握元素周期律的递变规律.

练习册系列答案
相关题目
6.金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等.已知:Ce4++Fe2+═Ce3++Fe3+.下列说法正确的是( )
| A. | Ce元素位于元素周期表第六周期第IIIB族 | |
| B. | ${\;}_{58}^{138}$Ce、${\;}_{58}^{142}$Ce是同素异形体 | |
| C. | 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2 | |
| D. | 铈的原子核外有58个电子 |
16.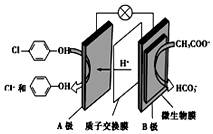 含乙酸钠和对氯酚(
含乙酸钠和对氯酚( 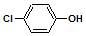 )的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )
 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(  )的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )| A. | B极是电解池的负极 | |
| B. | 电子从A极沿导线经小灯泡流向B极 | |
| C. | A极的电极反应式为: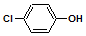 +e-═Cl-+ +e-═Cl-+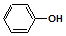 | |
| D. | 当外电路中有1 mol e-转移时,通过质子交换膜的H+为1 mol |
20.下列各物质中,互为同系物的是( )
| A. | HCOOCH3和 CH3COOH | B. | CHCl3和氯乙烷 | ||
| C. |  和 和 | D. |  和 和 |
10.下列有关化合物的说法正确的是( )
| A. | 明矾的主要成分是氢氧化铝 | B. | CH3OH可导致人体中毒 | ||
| C. | SO2可大量用于漂白食品 | D. | Na2CO3可以做胃药 |
17.下列实验过程中,溶液的pH大于7的是( )
| A. | 向KNO3溶液中滴加醋酸 | B. | 向KNO3溶液中滴加稀H2SO4 | ||
| C. | 向稀NaCl溶液中滴加稀HNO3 | D. | 向NaCl溶液中滴加Na2CO3溶液 |
14.关于溶液的pH值,下列说法正确的是( )
| A. | pH=0的溶液呈中性 | |
| B. | 某强碱溶液的浓度为0.01 mol/L,该溶液的pH值一定为12 | |
| C. | 溶液pH值越大,氢离子浓度越大 | |
| D. | 酸性溶液中,氢离子浓度一定大于氢氧根浓度 |
15.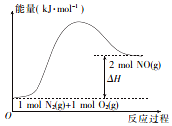 汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )
汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )
 汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )
汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )| A. | 该反应是放热反应 | |
| B. | 该反应是氧化还原反应 | |
| C. | 该反应过程中有共价键的断裂和形成 | |
| D. | 使用催化剂可以改变反应速率 |