题目内容
6. 将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.
将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.①一定有C2H4
②一定有CH4
③一定有C3H8
④一定没有C2H6
⑤可能有C2H2
⑥可能有C3H4
则上述对该混合烃的判断正确的是( )
| A. | ②③⑤ | B. | ⑤⑥ | C. | ②④⑥ | D. | ①④ |
分析 由图可知,1mol混合物燃烧生成1.6molCO2和2molH2O,两种气态烃的平均组成为C1.6H4,根据碳原子平均数可知,混合气体一定含有CH4,由氢原子平均数可知,另一气态烃中氢原子数目为4,碳原子数目大于1.6,不超过4,以此来解答.
解答 解:由图可知,1mol混合物燃烧生成1.6molCO2和2molH2O,两种气态烃的平均组成为C1.6H4,根据碳原子平均数可知,混合气体一定含有CH4,
①两种气态烃的平均组成为C1.6H4,根据碳原子平均数可知,混合气体一定含有CH4,由氢原子平均数可知,另一气态烃中氢原子数目为4,可能含有C2H4,或含有C3H4等,若含有C2H4,满足CH4与C2H4为2:3,故①不选;
②两种气态烃的平均组成为C1.6H4,根据碳原子平均数可知,混合气体一定含有CH4,故②选;
③C3H8中氢原子数目为8,氢原子数目大于4,不可能含有C3H8,故③不选;
④C2H6中氢原子数目为6,氢原子数目大于4,不可能含有C2H6,故④选;
⑤C2H2中氢原子数目为2,氢原子数目小于4,不可能含有C2H2,故⑤不选;
⑥由①的分析可知,可能含C3H4,故⑥选;
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握平均分子组成判断烃的组成为解答的关键,侧重分析能力和推断能力的考查,题目难度不大.

练习册系列答案
相关题目
16.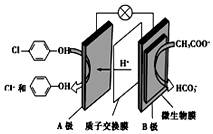 含乙酸钠和对氯酚(
含乙酸钠和对氯酚( 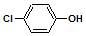 )的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )
 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(  )的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )| A. | B极是电解池的负极 | |
| B. | 电子从A极沿导线经小灯泡流向B极 | |
| C. | A极的电极反应式为: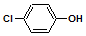 +e-═Cl-+ +e-═Cl-+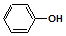 | |
| D. | 当外电路中有1 mol e-转移时,通过质子交换膜的H+为1 mol |
17.下列实验过程中,溶液的pH大于7的是( )
| A. | 向KNO3溶液中滴加醋酸 | B. | 向KNO3溶液中滴加稀H2SO4 | ||
| C. | 向稀NaCl溶液中滴加稀HNO3 | D. | 向NaCl溶液中滴加Na2CO3溶液 |
14.关于溶液的pH值,下列说法正确的是( )
| A. | pH=0的溶液呈中性 | |
| B. | 某强碱溶液的浓度为0.01 mol/L,该溶液的pH值一定为12 | |
| C. | 溶液pH值越大,氢离子浓度越大 | |
| D. | 酸性溶液中,氢离子浓度一定大于氢氧根浓度 |
1.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. |  2,6-二甲基-5-乙基庚烷 2,6-二甲基-5-乙基庚烷 | B. |  3-甲基-1-丁烯 3-甲基-1-丁烯 | ||
| C. | 二溴乙烷:CH2BrCH2Br | D. |  1,3,4-三甲苯 1,3,4-三甲苯 |
11.以下说法不正确的是( )
| A. | 乙醇不能与NaOH溶液反应,苯酚可以与NaOH溶液反应,说明苯环对羟基产生影响 | |
| B. | 苯不能被酸性KMnO4溶液氧化,甲苯可以被酸性KMnO4溶液氧化为苯甲酸,说明侧链对苯环产生了影响 | |
| C. | 苯与苯酚与溴水反应的条件、产物区别,说明羟基对苯环产生影响 | |
| D. | 苯和甲苯硝化反应产物的区别,说明甲基对苯环产生影响 |
15.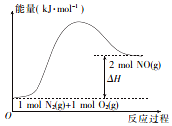 汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )
汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )
 汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )
汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )| A. | 该反应是放热反应 | |
| B. | 该反应是氧化还原反应 | |
| C. | 该反应过程中有共价键的断裂和形成 | |
| D. | 使用催化剂可以改变反应速率 |
20.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol•L-1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
(2)计算用0.001mol•L-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率1×10-4mol/(L•min)(忽略混合前后溶液的体积变化).
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?不行.(填“行”或“不行”)
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol•L-1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?不行.(填“行”或“不行”)



