题目内容
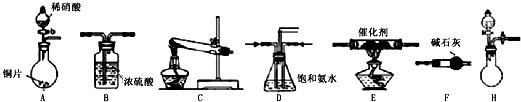
工业尾气中氮氧化物通常采用氨催化吸收法,其原理是3与NOx在催化剂作用F反应生成无毒的物质.某校活动小组同学采用如图装置和步骤模拟工业上氮氧化物的处理过程.
I.探究制取3的方法
(1)B装置的名称:
(2)在上述装置中,H能快速、简便制取,装置中需要添加的反应试剂为 .
(3)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得表中实验数据.分析表中数据,你认为哪种方案制取氨气的效果最好 (填序号),从该方案选择的原料分析制气效果好的可能原因是 , .
Ⅱ.模拟尾气处理
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验.
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复).
 → → →
→ → →
(2)A中反应的离子方程式为
(3)D装置的作用有: 、 、 .
(4)D装置中的液体还可换成 (填序号).
a.2 b.CCl4 c.浓H2SO4 d.CuSO4溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是 .

I.探究制取3的方法
(1)B装置的名称:
(2)在上述装置中,H能快速、简便制取,装置中需要添加的反应试剂为
(3)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得表中实验数据.分析表中数据,你认为哪种方案制取氨气的效果最好
| 试剂组合序号 | 固体试剂 | NH3体积(mL) | |
| a | 6.0g Ca(OH)2(过量) | 5.4g NH4Cl | 1344 |
| b | 5.4g (NH4)2SO4 | 1364 | |
| c | 6.0g NaOH(过量) | 5.4g NH4Cl | 1568 |
| d | 5.4g (NH4)2SO4 | 1559 | |
| e | 6.0g CaO(过量) | 5.4g NH4Cl | 1753 |
| f | 5.4g (NH4)2SO4 | 1792 | |
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验.
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复).
 →
→(2)A中反应的离子方程式为
(3)D装置的作用有:
(4)D装置中的液体还可换成
a.2 b.CCl4 c.浓H2SO4 d.CuSO4溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是
考点:性质实验方案的设计,常见的生活环境的污染及治理
专题:实验设计题,元素及其化合物
分析:Ⅰ.(1)根据B装置特点判断其名称是洗气瓶;
(2)制备氨气可采用加热NH4Cl和Ca(OH)2或浓氨水加热的方法制备,其中能快速、简便制取NH3的装置可用加热浓氨水法制备;
(3)根据NH4Cl受热易分解以及NaOH或Ca(OH)2作反应物产生的水较多的性质分析;
II.(1)根据实验目的和实验原理,选择仪器的连接顺序;
(2)稀硝酸具有强氧化性,与铜发生氧化还原反应生成硝酸铜和NO等;
(3)氨气难溶于饱和氨水,可防止倒吸;
(4)氨气为极性分子,不溶于非极性溶剂;
(5)缺少尾气处理装置,过量的NO会污染空气;
(2)制备氨气可采用加热NH4Cl和Ca(OH)2或浓氨水加热的方法制备,其中能快速、简便制取NH3的装置可用加热浓氨水法制备;
(3)根据NH4Cl受热易分解以及NaOH或Ca(OH)2作反应物产生的水较多的性质分析;
II.(1)根据实验目的和实验原理,选择仪器的连接顺序;
(2)稀硝酸具有强氧化性,与铜发生氧化还原反应生成硝酸铜和NO等;
(3)氨气难溶于饱和氨水,可防止倒吸;
(4)氨气为极性分子,不溶于非极性溶剂;
(5)缺少尾气处理装置,过量的NO会污染空气;
解答:
解:I.(1)B装置盛有浓硫酸做干燥剂,B装置的名称是洗气瓶,故答案为:洗气瓶;
(2)装置H为分液漏斗、圆底烧瓶,能快速、简便制取NH3,分液漏斗放浓氨水,圆底烧瓶放碱(生石灰或烧碱),
故答案为:生石灰与浓氨水(或烧碱与浓氨水);
(3)因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合成NH4Cl,而用NaOH或Ca(OH)2作反应物产生的水较多,吸收的NH3较多,(NH4)2SO4受热不分解,CaO又有吸水作用,由表中数据可以看出,f制NH3产率最高,
故答案为:f;(NH4)2SO4受热不分解,CaO又有吸水作用;
II.(1)该反应目的是模拟汽车尾气中CO和NOX的反应并测量反应后混合气体的组成,装置A生成的CO和装置C生成的NOx通入装置D使气体混合均匀、调节气流速度,装置F干燥气体,再通入装置E反应进行反应,反应后的气体通入装置B干燥,最后收集气体,
故答案为:F E B;
(2)稀硝酸具有强氧化性,与铜发生氧化还原反应生成硝酸铜和NO等,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)D装置使气体混合均匀、调节气流速度,另外,氨气难溶于饱和氨水,可防止倒吸,
故答案为:使气体混合均匀、调节气流速度、防止氨气溶解(或防止倒吸);
(4)氨气可溶于硫酸铜溶液、水以及硫酸中,可产生倒吸,氨气为极性分子,不溶于非极性溶剂,可用CCl4代替饱和氨水,
故答案为:b;
(5)缺少尾气处理装置,过量的NO会污染空气,
故答案为:未反应的NO无法处理,会污染环境.
(2)装置H为分液漏斗、圆底烧瓶,能快速、简便制取NH3,分液漏斗放浓氨水,圆底烧瓶放碱(生石灰或烧碱),
故答案为:生石灰与浓氨水(或烧碱与浓氨水);
(3)因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合成NH4Cl,而用NaOH或Ca(OH)2作反应物产生的水较多,吸收的NH3较多,(NH4)2SO4受热不分解,CaO又有吸水作用,由表中数据可以看出,f制NH3产率最高,
故答案为:f;(NH4)2SO4受热不分解,CaO又有吸水作用;
II.(1)该反应目的是模拟汽车尾气中CO和NOX的反应并测量反应后混合气体的组成,装置A生成的CO和装置C生成的NOx通入装置D使气体混合均匀、调节气流速度,装置F干燥气体,再通入装置E反应进行反应,反应后的气体通入装置B干燥,最后收集气体,
故答案为:F E B;
(2)稀硝酸具有强氧化性,与铜发生氧化还原反应生成硝酸铜和NO等,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)D装置使气体混合均匀、调节气流速度,另外,氨气难溶于饱和氨水,可防止倒吸,
故答案为:使气体混合均匀、调节气流速度、防止氨气溶解(或防止倒吸);
(4)氨气可溶于硫酸铜溶液、水以及硫酸中,可产生倒吸,氨气为极性分子,不溶于非极性溶剂,可用CCl4代替饱和氨水,
故答案为:b;
(5)缺少尾气处理装置,过量的NO会污染空气,
故答案为:未反应的NO无法处理,会污染环境.
点评:本题考查氮的氧化物的性质以及对环境的影响,题目难度中等,做题时注意实验的原理和目的,牢固掌握实验方法和实验基本操作为解答该类题目的前提.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
白酒、食醋、蔗糖、淀粉是家庭厨房中常用的烹调剂,利用这些物质能完成的实验是( )
| A、鉴别食盐和小苏打 |
| B、检验食盐中是否含KIO3 |
| C、检验自来水中是否含有氯离子 |
| D、检验白酒中是否含甲醇 |
下列实验操作正确的是( )
| A、在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,配制新制氢氧化铜悬浊液,检验醛基 |
| B、实验室制乙烯时,迅速升温到140℃ |
| C、用乙醇和浓硫酸除去乙酸乙酯中混有的少量乙酸 |
| D、用苯、2mol/L的硝酸和3mol/L的硫酸制硝基苯 |
下列关于氯水的说法中,不正确的是( )
| A、新制氯水具有漂白作用 |
| B、新制氯水呈黄绿色 |
| C、新制氯水应避光保存 |
| D、氯水是指液态的氯 |
在水溶液中能量共存的一组离子是( )
| A、Na+、Ba2+、Cl-、NO3- |
| B、Ba2+、Hg2+、S2-、SO42- |
| C、NH4+、H+、SO32-、PO43- |
| D、ClO-、Al3+、Br-、CO32- |
 (1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为
(1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为 一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol
一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol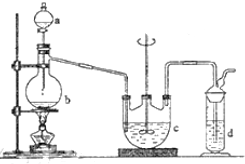 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题: