题目内容
 一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol
一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol(1)该反应中△H的含义是
①该反应到达平衡时放出的热量
②该条件下,1mol N2的3mol H2放在密闭容器中反应达平衡时放出的热量
③该条件下,密闭容器中化学达平衡生成2mol NH3时放出的热量
(2)下列叙述能说明该反应已经达到平衡状态的是
a.v(N2)正=3v(H2)逆
b.容器中气体的密度不随时间而变化
c.容器中气体的总压强不随时间而变化
d.容器中气体的平均相对分子质量不随时间而变化
(3)根据图判断,反应进行至25min时,曲线发生变化的原因可能是
(4)10min到20min时,曲线发生变化的原因可能是
a.降低温度 b.加入催化刘 c.缩小体积 d.增加NH3的物质的量.
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)根据可逆反应中△H的含义进行判断;
(2)根据化学平衡状态的特征进行判断;
(3)根据三种物质的量的变化判断曲线发生变化的原因;
(4)根据0min到10min时和10min到20min时曲线的变化判断各选项.
(2)根据化学平衡状态的特征进行判断;
(3)根据三种物质的量的变化判断曲线发生变化的原因;
(4)根据0min到10min时和10min到20min时曲线的变化判断各选项.
解答:
解:(1)可逆反应中的焓变的含义为完全转化为生成物时,所产生的焓的变化,只有③描述合理,故答案为:③;
(2)a.v(N2)正=3v(H2)逆,即v(N2)正=3×[3v(N2)逆]=9v(N2)逆,未达化学平衡状态,故A错误;
b.ρ=
,气体质量和总体积都不随化学平衡的移动而变化,不能判断化学平衡状态,故b错误;
c.反应前后气体体积不同,即压强不变时,达到化学平衡状态,故c正确;
d.M=
,气体质量不变,气体总物质的量不同,当平均相对分子质量不变时,则达到了化学平衡状态,故d正确;
故选:cd;
(3)25min时,N2和H2物质的量不变,NH3物质的量瞬间减小,可知曲线发生变化的原因可能是:其它条件不变时,减小氨气的量,
故答案为:其它条件不变时,减小氨气的量;
(4)0min到10min时不如10min到20min时曲线变化快,即化学反应速率增大,
a、降低温度,化学反应速率降低,故a错误;
b、加入催化剂,加快反应速率,故b正确;
c、缩小体积,浓度增大,化学反应速率增大,故c正确;
d、增加NH3的物质的量,则曲线中NH3的物质的量突然增大,而曲线中NH3的物质的量并未突然增大,故d错误,
故选:bc.
(2)a.v(N2)正=3v(H2)逆,即v(N2)正=3×[3v(N2)逆]=9v(N2)逆,未达化学平衡状态,故A错误;
b.ρ=
| m |
| V |
c.反应前后气体体积不同,即压强不变时,达到化学平衡状态,故c正确;
d.M=
| m |
| n |
故选:cd;
(3)25min时,N2和H2物质的量不变,NH3物质的量瞬间减小,可知曲线发生变化的原因可能是:其它条件不变时,减小氨气的量,
故答案为:其它条件不变时,减小氨气的量;
(4)0min到10min时不如10min到20min时曲线变化快,即化学反应速率增大,
a、降低温度,化学反应速率降低,故a错误;
b、加入催化剂,加快反应速率,故b正确;
c、缩小体积,浓度增大,化学反应速率增大,故c正确;
d、增加NH3的物质的量,则曲线中NH3的物质的量突然增大,而曲线中NH3的物质的量并未突然增大,故d错误,
故选:bc.
点评:本题考查化学平衡图象、影响化学反应速率的因素、化学反应速率的计算等,难度不大,注意掌握平衡移动原理,根据图象判断温度对平衡移动的影响.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
下列叙述不正确的( )
| A、金属材料分为黑色金属材料和有色金属材料 |
| B、活泼金属在空气中易与氧气反应,表面生成一层氧化膜均能保护内层金属 |
| C、硅是一种亲氧元素,在自然界中它总是与氧相互化合的 |
| D、氯是最重要的“成盐元素”,主要以NaCl的形成存在于海水和陆地的盐矿中 |
 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)═2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)═2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A、若b、c点的平衡常数分别为K1、K2,则K1>K2 |
| B、a、b两点的反应速率:b>a |
| C、为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法 |
| D、若平衡后保持温度不变,压缩容器体积平衡一定不移动 |
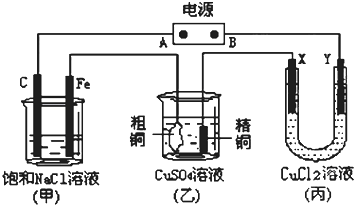
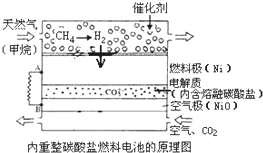 以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池如图,下列说法不正确的是( )
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池如图,下列说法不正确的是( )| A、外电路电子流动方向:由A流向B |
| B、空气极发生反应的离子方程式是O2+4e-=2O2- |
| C、以此燃料电池为电源电解精炼铜,当电路有0.6mol e?转移,有19.2g精铜析出 |
| D、负极反应为H2-2e-+CO32-=CO2+H2O |

 →
→
 试管B中的试剂为澄清石灰水.向试管A中滴入盐酸.
试管B中的试剂为澄清石灰水.向试管A中滴入盐酸.