题目内容
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.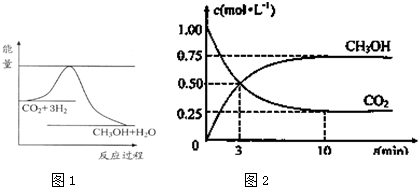
(1)关于该反应的下列说法中,正确的是 .(填字母)
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0且在 (填“较高”或“较低”)温度下有利于该反应自发进行.
(2)该反应平衡常数K的表达式为 .
(3)下列情况不能说明该反应一定达到平衡的是
A.混合气体的平均平均相对分子质量不变 B.混合气体的压强不变
C.单位时间内生成3mol H-H键,同时生成2mol H-O键
D.混合气体中c (CO2):c (H2)=1:3
(4)温度降低,平衡常数K (填“增大”、“不变”或“减小”).
(5)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为 mol?L-1?min-1,CO2和H2的转化率比是
(6)下列措施中能使(5)题中n(CH3OH)/n(CO2)增大的有 .(填字母)
A.升高温度 B.加入催化剂 C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大 E.再充入1molCO2和3molH2
(7)若在另一个密闭容器中充入1mol CO2和3mol H2,保持压强不变,并使初始体积与题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数 (5)题中的CO2的体积百分数.(“>”或“<”或“=”,下同)
(8)若为两个容积相同的密闭绝热容器,现向甲容器中充入1mol CO2(g)和3molH2(g),乙容器中充入1mol CH3OH(g)和1mol H2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH) 乙容器内n(CH3OH).

(1)关于该反应的下列说法中,正确的是
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0且在
(2)该反应平衡常数K的表达式为
(3)下列情况不能说明该反应一定达到平衡的是
A.混合气体的平均平均相对分子质量不变 B.混合气体的压强不变
C.单位时间内生成3mol H-H键,同时生成2mol H-O键
D.混合气体中c (CO2):c (H2)=1:3
(4)温度降低,平衡常数K
(5)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为
(6)下列措施中能使(5)题中n(CH3OH)/n(CO2)增大的有
A.升高温度 B.加入催化剂 C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大 E.再充入1molCO2和3molH2
(7)若在另一个密闭容器中充入1mol CO2和3mol H2,保持压强不变,并使初始体积与题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数
(8)若为两个容积相同的密闭绝热容器,现向甲容器中充入1mol CO2(g)和3molH2(g),乙容器中充入1mol CH3OH(g)和1mol H2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH)
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,由方程式可知,该反应正反应是气体的物质的量减小的反应,故正反应为熵减过程;
(2)化学平衡常数,是指在一定温度下,达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(3)根据化学平衡状态特征判断是否达到化学平衡状态;
(4)该反应正反应是放热反应,降低温度平衡向正反应移动,平衡常数增大;
(5)由图2可知,甲醇的浓度变化量为0.75mol/L,根据v=
计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);根据加入CO2和H2的物质的量之比和转化的物质的量之比获得转化率之比;
(6)使n(CH3OH)/n(CO2)增大,改变条件使平衡向正反应移动,但只增大二氧化碳的浓度会使该比值减小;
(7)比较该加入反应物条件下与(5)的压强比较,再比较容器中的CO2的体积百分数;
(8)温度始终不变,从不同方向建立化学平衡,其热效应不同,据此判断.
(2)化学平衡常数,是指在一定温度下,达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(3)根据化学平衡状态特征判断是否达到化学平衡状态;
(4)该反应正反应是放热反应,降低温度平衡向正反应移动,平衡常数增大;
(5)由图2可知,甲醇的浓度变化量为0.75mol/L,根据v=
| △c |
| △t |
(6)使n(CH3OH)/n(CO2)增大,改变条件使平衡向正反应移动,但只增大二氧化碳的浓度会使该比值减小;
(7)比较该加入反应物条件下与(5)的压强比较,再比较容器中的CO2的体积百分数;
(8)温度始终不变,从不同方向建立化学平衡,其热效应不同,据此判断.
解答:
解:(1)由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即△H<0,由方程式可知,该反应正反应是气体的物质的量减小的反应,故正反应为熵减过程,即△S<0;
故选C;
(2)可逆反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的化学平衡常数k=
,故答案为:
;
(3)A.M=
,气体的质量不变,但是反应前后气体的物质的量不同,则平均相对分子质量也会随着反应的进行而变化,当平均相对分子质量不变时,达到化学平衡状态,故A正确;
B.反应前后气体的物质的量不同,则反应前后气体压强不同,当压强不变时,达到化学平衡状态,故B正确;
C.单位时间内生成3mol H-H键,同时生成2mol H-O键,均为正反应方向,不能判断是否达到化学平衡状态,故C错误;
D.并不能说明各物质的物质的量不变,不能判断是否达到化学平衡状态,故D错误;
故选:C、D;
(4)该反应正反应是放热反应,降低温度平衡向正反应移动,平衡常数增大;
故答案为:增大;
(5)由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=
=0.075mol/(L?min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L?min)=0.225mol/(L?min);由于加入1molCO2和3molH2,起始的物质的量之比为1:3,转化的和3molH2之比也为1:3,则二者转化率之比同样为1:1,故答案为:0.225,1:1;
(6)使n(CH3OH)/n(CO2)增大,改变条件使平衡向正反应移动,但只增大二氧化碳的浓度会使该比值减小.
A.升高温度,平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误;
B.加入催化剂,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确;
D.充入He(g),反应混合物的浓度不变,变化不移动,n(CH3OH)/n(CO2)不变,故D错误;
E.再充入1mol CO2和3mol H2,等效为增大压强,平衡正反应移动,平衡时n(CH3OH)/n(CO2)增大,故E正确;
故选C、E;
(7)恒容条件下,该反应前气体物质的量大于反应后气体物质的量,随着反应进行体系压强减小,不利于反应的正向进行,恒压条件下,压强大于恒容条件下压强,所以CO2的体积百分数小于(5)题中的CO2的体积百分数,故答案为:<;
(8)温度始终不变,甲容器中充入1mol CO2(g)和3molH2(g),建立化学平衡时,放出热量,温度不变有利于反应的进行,乙容器中充入1mol CH3OH(g)和1mol H2O(g),吸收热量,温度不变不利于反应的进行,即甲容器内n(CH3OH)小于乙容器内n(CH3OH),故答案为:<.
故选C;
(2)可逆反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的化学平衡常数k=
| c(CH3OH)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO)?c3(H2) |
(3)A.M=
| m |
| n |
B.反应前后气体的物质的量不同,则反应前后气体压强不同,当压强不变时,达到化学平衡状态,故B正确;
C.单位时间内生成3mol H-H键,同时生成2mol H-O键,均为正反应方向,不能判断是否达到化学平衡状态,故C错误;
D.并不能说明各物质的物质的量不变,不能判断是否达到化学平衡状态,故D错误;
故选:C、D;
(4)该反应正反应是放热反应,降低温度平衡向正反应移动,平衡常数增大;
故答案为:增大;
(5)由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=
| 0.75mol/L |
| 10min |
(6)使n(CH3OH)/n(CO2)增大,改变条件使平衡向正反应移动,但只增大二氧化碳的浓度会使该比值减小.
A.升高温度,平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误;
B.加入催化剂,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确;
D.充入He(g),反应混合物的浓度不变,变化不移动,n(CH3OH)/n(CO2)不变,故D错误;
E.再充入1mol CO2和3mol H2,等效为增大压强,平衡正反应移动,平衡时n(CH3OH)/n(CO2)增大,故E正确;
故选C、E;
(7)恒容条件下,该反应前气体物质的量大于反应后气体物质的量,随着反应进行体系压强减小,不利于反应的正向进行,恒压条件下,压强大于恒容条件下压强,所以CO2的体积百分数小于(5)题中的CO2的体积百分数,故答案为:<;
(8)温度始终不变,甲容器中充入1mol CO2(g)和3molH2(g),建立化学平衡时,放出热量,温度不变有利于反应的进行,乙容器中充入1mol CH3OH(g)和1mol H2O(g),吸收热量,温度不变不利于反应的进行,即甲容器内n(CH3OH)小于乙容器内n(CH3OH),故答案为:<.
点评:考查平衡图象、化学平衡有关计算、反应速率、化学平衡的影响因素等,难度不大,注意基础知识的理解掌握,其中第(8)难度较大.

练习册系列答案
相关题目
下列说法中,正确的是( )
| A、SiO2是硅酸的酸酐,可与水化合生成硅酸 |
| B、CO2通入水玻璃中可以得到硅酸 |
| C、在高温是SiO2与Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强 |
| D、SiO2是酸性氧化物,它不溶于任何酸 |
下列有关说法正确的是( )
| A、在多电子的原子里,能量高的电子通常在离核近的区域内运动 |
| B、最外层电子数为8的微粒均是稀有气体元素的原子 |
| C、俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
| D、在周期表中金属和非金属的分界线附近寻找制备半导体材料 |
NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A、Fe与标准状况下2.24L Cl2恰好完全反应,转移电子数目为0.2NA |
| B、0.5mol Na2O2和0.5mol Na2O组成的混合物中,含阴离子数目为1.5NA |
| C、17g NH3分子中含有的共用电子对数为3NA |
| D、1.7g OH-所含电子总数为NA |
 →
→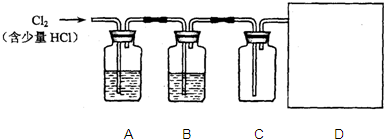
 试管B中的试剂为澄清石灰水.向试管A中滴入盐酸.
试管B中的试剂为澄清石灰水.向试管A中滴入盐酸.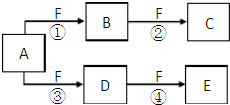 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.