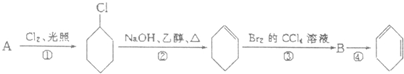
题目内容
在水溶液中能量共存的一组离子是( )
| A、Na+、Ba2+、Cl-、NO3- |
| B、Ba2+、Hg2+、S2-、SO42- |
| C、NH4+、H+、SO32-、PO43- |
| D、ClO-、Al3+、Br-、CO32- |
考点:离子共存问题
专题:离子反应专题
分析:根据离子之间不能结合生成水、气体、沉淀、弱电解质,不能相互促进水解等,则离子大量共存,以此来解答.
解答:
解:A.该组离子之间不反应,可大量共存,故A正确;
B.Hg2+、S2-结合生成沉淀,Ba2+、SO42-结合生成沉淀,不能大量共存,故B错误;
C.H+分别与SO32-、PO43-结合弱电解质,不能大量共存,故C错误;
D.Al3+、CO32-相互促进水解生成沉淀和气体,不能大量共存,故D错误;
故选A.
B.Hg2+、S2-结合生成沉淀,Ba2+、SO42-结合生成沉淀,不能大量共存,故B错误;
C.H+分别与SO32-、PO43-结合弱电解质,不能大量共存,故C错误;
D.Al3+、CO32-相互促进水解生成沉淀和气体,不能大量共存,故D错误;
故选A.
点评:本题考查离子的共存,为高频考点,把握离子之间的反应为解答的关键,侧重复分解反应、水解反应的离子共存考查,注意选项D为解答的易错点,题目难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
下列有关说法正确的是( )
| A、在多电子的原子里,能量高的电子通常在离核近的区域内运动 |
| B、最外层电子数为8的微粒均是稀有气体元素的原子 |
| C、俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
| D、在周期表中金属和非金属的分界线附近寻找制备半导体材料 |
将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO4═Fe2O3+SO2↑+SO3↑,如将生成的混合气体通过BaCl2溶液,应发生的现象有( )
| A、一定产生BaSO3沉淀 |
| B、一定产生BaSO4沉淀 |
| C、产生的不全是BaSO4沉淀 |
| D、一定有SO3逸出 |
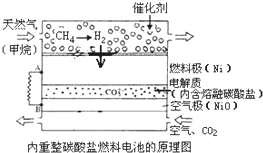 以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池如图,下列说法不正确的是( )
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池如图,下列说法不正确的是( )| A、外电路电子流动方向:由A流向B |
| B、空气极发生反应的离子方程式是O2+4e-=2O2- |
| C、以此燃料电池为电源电解精炼铜,当电路有0.6mol e?转移,有19.2g精铜析出 |
| D、负极反应为H2-2e-+CO32-=CO2+H2O |
下列说法正确的是( )
| A、装饰材料中的甲醛和芳香烃会造成居室污染 |
| B、石蜡油分解产生的气体不能使酸性高锰酸钾溶液褪色 |
| C、分子组成为CH2Cl2和C2H6O的有机物都存在同分异构现象 |
| D、油脂、葡萄糖、蛋白质都是人体重要的营养物质,它们都能发生水解反应 |
NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A、Fe与标准状况下2.24L Cl2恰好完全反应,转移电子数目为0.2NA |
| B、0.5mol Na2O2和0.5mol Na2O组成的混合物中,含阴离子数目为1.5NA |
| C、17g NH3分子中含有的共用电子对数为3NA |
| D、1.7g OH-所含电子总数为NA |
同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
| A、原子半径:X>Y>Z |
| B、元素的非金属性:X>Y>Z |
| C、气态氢化物稳定性:X<Y<Z |
| D、原子序数:Z>Y>X |
 →
→