题目内容
12.用如图所示装置进行实验.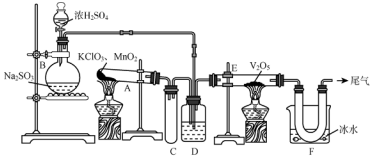
(1)烧瓶B内发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(2)小试管C的作用是防倒吸.
(3)广口瓶D内盛的试剂是浓硫酸,装置D的3个作用是:①干燥SO2②使SO2和O2两种气体混合均匀③控制气体的流速.
(4)玻璃管E内发生反应的化学方程式是SO2+O2$?_{△}^{V_{2}O_{5}}$SO3.
(5)装置F中U形管中所收集物质的成分是SO3.
(6)若U形管内收集到的物质很少,分析其原因不可能是b(填序号).
a.装置气密性不好;
b.制得的SO2中混有少量H2S杂质使催化剂中毒;
c.气流速度过快.
(7)从U形管导出的尾气的处理方法是用碱液吸收SO2,相关反应的离子方程式为SO2+2OH-=SO32-+H2O.
分析 B装置制备二氧化硫,A装置制备氧气,经D装置干燥后在E装置反应生成三氧化硫,F装置收集制备的三氧化硫,最后尾气处理,
(1)装置B中为亚硫酸钠与浓硫酸制备二氧化硫的反应;
(2)小试管的作用为防倒吸;
(3)依据通入E装置,D中应放入浓硫酸.作用①干燥SO2;②使SO2和O2两种气体混合均匀;③通过观察气泡控制气体比例和气流速度;
(4)E装置中SO2与O2催化氧化反应;
(5)根据SO3在0℃时凝结为固态分析;
(6)根据浓硫酸与H2S气体反应;
(7)尾气的成分为二氧化硫,酸性气体,选择碱液氢氧化钠吸收.
解答 解:(1)装置B中为亚硫酸钠与浓硫酸制备二氧化硫的反应,化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)小试管C可以作为缓冲瓶,有效防倒吸;
故答案为:防倒吸;
(3)E装置为二氧化硫与氧气催化氧化生成三氧化硫的装置,D中应放入浓硫酸,作用①干燥SO2;②使SO2和O2两种气体混合均匀;③通过观察气泡控制气体比例和气流速度;
故答案为:浓硫酸;干燥SO2;使SO2和O2两种气体混合均匀;
(4)E装置为二氧化硫与氧气催化氧化生成三氧化硫的装置,反应为:SO2+O2$?_{△}^{V_{2}O_{5}}$SO3;
故答案为:SO2+O2$?_{△}^{V_{2}O_{5}}$SO3;
(5)SO3在0℃时凝结为固态,故U形管中所收集物质的成分是三氧化硫;
故答案为:SO3;
(6)浓硫酸与H2S气体反应,则在浓硫酸的作用下不可能有H2S气体,选择b;
故答案为:b;
(7)尾气的成分为二氧化硫,酸性气体,选择碱液吸收,离子方程式为:SO2+2OH-=SO32-+H2O;
故答案为:用碱液吸收SO2;SO2+2OH-=SO32-+H2O.
点评 本题考查了物质制备方案设计,主要考查了化学方程式的书写、实验方案评价、氧化还原反应、环境保护等,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | V(NaOH)=10时,c(OH-)+c(H2C2O4)═c(C2O42-)+c(H+) | |
| B. | V(NaOH)=100 mL时,可能存在c(Na+)>2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=1000 mL时,c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | V(NaOH)=10 mL时,溶液中c(H+)=1×10-12 mol/L |
| A. | 该溶液的PH大于1 | |
| B. | c(OH-)=c(H+)-C(CH3COO-) | |
| C. | 与等体积、等浓度的NaOH溶液完全中和后,溶液显中性 | |
| D. | 与足量锌反应比等体积、等浓度的盐酸反应速率慢,生成氢气的质量相等 |
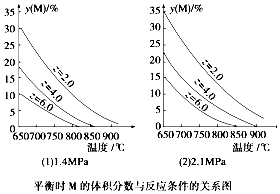
| A. | a+b<c+d | |
| B. | 同温同压时,增加z,平衡时Q的体积分数增加 | |
| C. | 同压同z时,升高温度,气体平均摩尔质量增加 | |
| D. | 同温同z时,增加压强,平衡时Q的物质的量浓度减小 |
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
| A. | f能级 | B. | d能级 | C. | s能级 | D. | p级 |
| A. | 2 | B. | 1 | C. | 0.5 | D. | 0.25 |
| A. | HCl | B. | NaOH | C. | CH3COONa | D. | Na2SO4 |