题目内容
20.常温下,对于1L0.1mol/L的醋酸溶液,下列判断不正确的是( )| A. | 该溶液的PH大于1 | |
| B. | c(OH-)=c(H+)-C(CH3COO-) | |
| C. | 与等体积、等浓度的NaOH溶液完全中和后,溶液显中性 | |
| D. | 与足量锌反应比等体积、等浓度的盐酸反应速率慢,生成氢气的质量相等 |
分析 A.醋酸在溶液中部分电离;
B.根据溶液中的电荷守恒分析;
C.醋酸与氢氧化钠反应生成醋酸钠,醋酸钠水解显碱性;
D.酸溶液中氢离子浓度越大,与锌反应的速率越快.
解答 解:A.醋酸在溶液中部分电离,所以常温下,对于1L0.1mol/L的醋酸溶液中氢离子浓度小于0.1mol/L,则溶液的PH大于1,故A正确;
B.1L0.1mol/L的醋酸溶液中的电荷守恒为c(OH-)+C(CH3COO-)=c(H+),则c(OH-)=c(H+)-C(CH3COO-),故B正确;
C.1L0.1mol/L的醋酸溶液与等体积、等浓度的NaOH溶液完全中和,醋酸与氢氧化钠恰好反应生成醋酸钠,醋酸钠水解显碱性,故C错误;
D.1L0.1mol/L的醋酸溶液,1L0.1mol/L的盐酸溶液,盐酸中氢离子浓度大,盐酸与锌反应的速率快,由于两种酸的物质的量相同,所以生成的氢气相同,故D正确.
故选C.
点评 本题考查弱电解质的电离,知道弱电解质电离影响因素是解本题关键,再结合守恒思想解答,题目难度不大,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
8.已知20°C时AgBr的溶解度为8.4×10-6AgCl的溶解度为1.5×10-4将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓硝酸银,发生的反应为( )
| A. | AgCl沉淀多于AgBr沉淀 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | 只有AgBr沉淀生成 |
15.含FeS286%的黄铁矿燃烧时损失硫5%,由SO2转化为SO3时转化率为99%,则生产98%硫酸1吨,需黄铁矿的质量为( )
| A. | 0.742吨 | B. | 0.85吨 | C. | 0.875吨 | D. | 1吨 |
5.向14.8g Fe2O3、FeO和Cu的混合物中,加入1mol•L-1硫酸溶液200mL时,固体恰好完全溶解,所得溶液中不含Fe3+.若用足量的CO在高温下还原相同质量的原混合物,得到的固体质量为( )
| A. | 11.6g | B. | 10.8g | C. | 8.4g | D. | 13.2g |
7.下列有关实验原理或实验操作正确的是( )
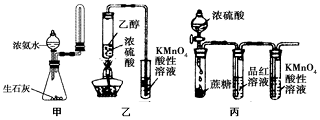

| A. | 实验室用图甲所示装置制取少量氨气 | |
| B. | 为使100ml0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50ml水 | |
| C. | 利用图乙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化 | |
| D. | 利用图丙装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
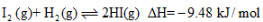
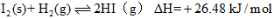
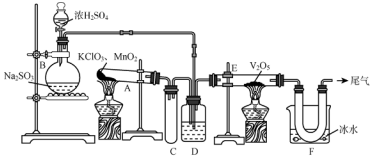
 ;
;