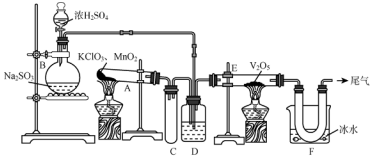
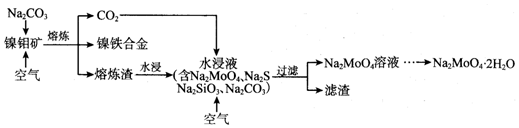
题目内容
7.反应Am(g+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )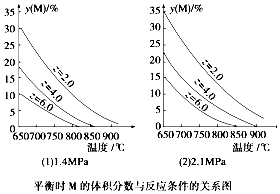
| A. | a+b<c+d | |
| B. | 同温同压时,增加z,平衡时Q的体积分数增加 | |
| C. | 同压同z时,升高温度,气体平均摩尔质量增加 | |
| D. | 同温同z时,增加压强,平衡时Q的物质的量浓度减小 |
分析 对比(1)(2)两个图象,温度升高,M的体积分数减小,说明正反应为吸热反应,同温同Z时,增加压强,M的体积分数增大,说明a+b<c+d,由图象可知,Z值越大,M的体积分数越小,催化剂同程度影响化学反应速率,对平衡移动无影响.
解答 解:A、同温同Z时,增加压强,M的体积分数增大,说明a+b<c+d,故A正确;
B、由图象可知,Z值越大,M的体积分数越小,有利于M的转化率的提高,但Q的体积分数不一定增大,如加入N的物质的量较多,虽然有利于平衡右移,但Q的体积分数依然较小,故B错误;
C、对比(1)(2)两个图象,温度升高,M的体积分数减小,说明正反应为吸热反应,同压同Z时,升高温度,平衡向正反应方向移动,气体的物质的量增加,则平衡时气体平均摩尔质量减小,故C错误;
D、同温同Z时,增加压强,M的体积分数增大,说明a+b<c+d,平衡向逆反应方向移动,则Q的体积分数减小,平衡移动的结果是减弱,而不是抵消,所以浓度增加,而不是减少,故D错误;
故选A.
点评 本题考查化学平衡移动图象问题的分析,题目难度中等,注意对比两个图象曲线变化特征,分析温度、压强对平衡移动的影响.

练习册系列答案
相关题目
15.含FeS286%的黄铁矿燃烧时损失硫5%,由SO2转化为SO3时转化率为99%,则生产98%硫酸1吨,需黄铁矿的质量为( )
| A. | 0.742吨 | B. | 0.85吨 | C. | 0.875吨 | D. | 1吨 |
2.常温下,Ksp(CaSO4)=9×10-6,CaSO4在水中的沉淀溶解平衡曲线如图所示.下列判断错误的是( )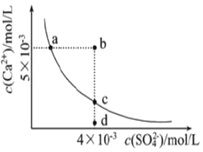

| A. | a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 | |
| B. | a点对应的Ksp不等于c点对应的Ksp | |
| C. | b点将有沉淀生成,平衡后溶液中c(Ca2+)•c(SO42-)一定等于9×10-6 | |
| D. | 向d点溶液中加入适量CaCl2固体可以变成c点 |
16.25℃时,下列溶液中的微粒浓度的关系正确的是( )
| A. | pH=4的CH3COOH溶液中,由水电离出来的c(H+)=1.0×10-4mol•L-1 | |
| B. | 物质的量浓度相等的①(NH4)2SO3溶液和②NH4HSO4溶液中c(NH4)+:①<② | |
| C. | pH=3的0.1mol•L-1 NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H2CO3)+c(H+) |