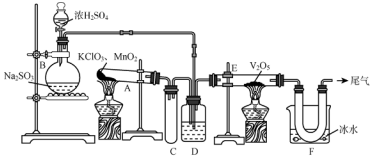
题目内容
3.已知:草酸又名乙二酸,其一级电离常数Ka1=5.9×10-2,二级电离常数Ka2=6.4×10-5.常温下,向10mL 0.01mol•L-1 NaHC2O4溶液中滴加0.01mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )| A. | V(NaOH)=10时,c(OH-)+c(H2C2O4)═c(C2O42-)+c(H+) | |
| B. | V(NaOH)=100 mL时,可能存在c(Na+)>2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=1000 mL时,c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | V(NaOH)=10 mL时,溶液中c(H+)=1×10-12 mol/L |
分析 A.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,溶液中存在电荷守恒和物料守恒分析;
B.V(NaOH)=100 mL时,溶液显碱性,结合电荷守恒分析;
C.V(NaOH)=1000 mL时,氢氧化钠大量存在,c(HC2O4-)<c(C2O42-);
D.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,存在水解平衡:C2O42-+H2O?HC2O4-+OH-,结合定量平衡常数和离子积常数计算分析.
解答 解:A.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,溶液中存在电荷守恒c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4- )+c(OH-),溶液中物料守恒为:c(Na+)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4),得到c(OH-)=2c(H2C2O4)+c(HC2O4- )+c(H+),故A错误;
B.V(NaOH)=100 mL时,溶液显碱性,c(H+)<c(OH-),c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4- )+c(OH-),一定存在c(Na+)>2c(C2O42-)+c(HC2O4-),故B错误;
C.V(NaOH)=1000 mL时,氢氧化钠大量存在,c(HC2O4-)<c(C2O42-),c(Na+)>c(C2O42-)>c(HC2O4-)>c(H2C2O4),故C正确;
D.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,存在水解平衡:C2O42-+H2O?HC2O4-+OH-,Kh=$\frac{c(O{H}^{-})c(H{C}_{2}{{O}_{4}}^{-})}{c({C}_{2}{{O}_{4}}^{2-})}$=$\frac{c(O{H}^{-})c(H{C}_{2}{{O}_{4}}^{-})}{c({C}_{2}{{O}_{4}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{2}}$=$\frac{1{0}^{-14}}{6.4×1{0}^{-5}}$=1.56×10-10,故D错误;
故选C.
点评 本题考查溶液中离子的关系,明确溶液中的溶质是解答的关键,并注意利用溶液中水解的程度及电离的程度、电荷守恒来分析解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | AgCl沉淀多于AgBr沉淀 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | 只有AgBr沉淀生成 |
| A. | 0.742吨 | B. | 0.85吨 | C. | 0.875吨 | D. | 1吨 |
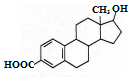
| A. | 该有机物的分子式为C19H22O3 | |
| B. | 该分子中所有碳原子不可能在同一个平面内 | |
| C. | 能发生加成反应、取代反应、水解反应 | |
| D. | 能与Na、NaOH溶液反应,但不能与NaHCO3溶液反应 |