题目内容
6.对于已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂( )
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ④⑥ |
分析 ①生成物质量增大小于混合物总质量增大,生成物的质量分数可能降低;
②平衡向正反应移动,生成物的产量一定增加;
③增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低;
④如增大反应物的浓度,平衡向正方向移动,达到平衡时,反应物的浓度比改变条件前大;
⑤平衡向正反应移动,正反应速率一定大于逆反应速率;
⑥加入催化剂,正逆反应速率同等程度增大,平衡不移动.
解答 解:①总质量不变,向正反应移动,生成物的质量分数一定增大,若生成物质量增大小于混合物总质量增大,生成物的质量分数可能降低,故①错误;
②平衡向正反应移动,生成物会增加,即生成物的产量一定增加,故②正确;
③降低生成物的浓度,平衡向正反应方向移动,反应物的转化率一定增大,但增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低,故③错误;
④如增大反应物的浓度,平衡向正方向移动,达到平衡时,反应物的浓度比改变条件前大,故④错误;
⑤平衡向正反应移动,正反应速率一定大于逆反应速率,故⑤正确;
⑥加入催化剂,正逆反应速率同等程度增大,平衡不移动,故⑥错误;
综上所述②⑤正确,
故选B.
点评 本题考查化学平衡的影响因素,题目难度中等,注意影响化学平衡移动的因素,解答时注意从勒沙特列原理的角度分析,侧重于考查学生的分析能力.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
16.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 石油、沼气、天然气、植物油都属于可再生能源 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 水蒸气变为液态水时放出的能量就是该变化的反应热 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
17.铅蓄电池反应如下:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,对铅蓄电池工作情况,下列叙述错误的是( )
| A. | 放电时Pb极为负极 | |
| B. | 充电时蓄电池上标有“+”号电极连接电源正极 | |
| C. | 放电时正极反应为PbO2+SO42-+4H++2e═PbSO4+2H2O | |
| D. | 充电时蓄电池上标有“-”号的电极发生氧化反应 |
14.某化工厂采用稀NaOH溶液脱除CO2.若碱洗脱除后所得废液的pH约为13(已知:相同温度下饱和Na2CO3溶液的pH约为12),则下列说法正确的是( )
| A. | 该溶液中:c(OH-)>c(Na+)>c(CO32-)>c(HCO3-)>c(H+) | |
| B. | 该溶液中:c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-) | |
| C. | 加水稀释该溶液,恢复至原温度,pH增大,Kw不变 | |
| D. | 该溶液pH约为13的原因:CO32-+H2O═HCO3-+OH- |
1.对于25℃时的0.1mol.L-1的氨水,下列说法正确的是( )
| A. | 加水稀释后所有的离子浓度均减小 | |
| B. | 与等体积等浓度的盐酸反应后,有:c(NH3.H2O)+c(OH-)=c(H+) | |
| C. | 加入等浓度的盐酸到pH=7时,有:c(NH4+)+c(NH3.H2O)=c(Cl-) | |
| D. | 该溶液在与盐酸完全中和的过程中,H2O的电离度不断增大 |
18.下列说法正确的是( )
| A. | 摩尔是一种物理量 | |
| B. | 溶液中或熔融状态下能导电的物质就是电解质 | |
| C. | 氧化还原反应的本质是元素化合价发生了变化 | |
| D. | 得电子的物质被还原,是氧化剂 |
15.有机物甲、乙的结构如图所示.下列说法错误的是( )
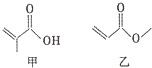
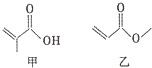
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能与溴的单质发生加成反应 | |
| C. | 一定条件下,甲、乙均能发生取代反应 | |
| D. | 甲、乙都能与金属钠反应生成氢气 |
16.下列有关0.1mol/LNa2S溶液的叙述正确的是( )
| A. | 该溶液中存在两个平衡、七种粒子 | |
| B. | 该溶液中K+、NH4+、NO3-、Al3+可以大量共存 | |
| C. | 滴加少量稀硫酸,充分振荡无现象 | |
| D. | 通入足量SO2气体,发生反应的离子方程式:2S2-+SO2+2H2O═3S↓+4OH- |