题目内容
1.对于25℃时的0.1mol.L-1的氨水,下列说法正确的是( )| A. | 加水稀释后所有的离子浓度均减小 | |
| B. | 与等体积等浓度的盐酸反应后,有:c(NH3.H2O)+c(OH-)=c(H+) | |
| C. | 加入等浓度的盐酸到pH=7时,有:c(NH4+)+c(NH3.H2O)=c(Cl-) | |
| D. | 该溶液在与盐酸完全中和的过程中,H2O的电离度不断增大 |
分析 A.稀释过程中氢氧根离子浓度减小,由于水的离子积不变,则氢离子浓度增大;
B.与等体积等浓度的盐酸反应后,两溶液恰好反应生成氯化铵,根据氯化铵溶液中的质子守恒判断;
C.溶液的pH=7,为中性溶液,则c(OH-)=c(H+),结合电荷守恒判断c(NH4+)与c(Cl-)大小;
D.氨水中氢氧根离子浓度越小,则水的电离程度越大,该溶液在与盐酸完全中和的过程中,氢氧根离子浓度逐渐减小,则水的电离程度逐渐增大
解答 解:A.加水稀释时,促进一水合氨电离,但是溶液中氢氧根离子浓度减小,由于水的离子积不变,则氢离子浓度增大,故A错误;
B.两溶液恰好反应生成氯化铵,根据氯化铵溶液中的质子守恒可知:c(NH3•H2O)+c(OH-)=c(H+),故B正确;
C.溶液的pH=7,则c(OH-)=c(H+),结合电荷守恒可知:c(NH4+)=c(Cl-),故C错误;
D.氨水中氢氧根离子浓度越小,则水的电离程度越大,该溶液在与盐酸完全中和的过程中,氢氧根离子浓度逐渐减小,则水的电离程度逐渐增大,故D正确;
故选BD.
点评 本题考查离子浓度大小比较,题目难度中等,明确弱电解质的电离平衡及其影响为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义及应用方法,A为易错点,注意温度不变,电离平衡常数不变,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
11.下列有关物质分类正确的是( )
| A. | NO2、CO、CO2均为酸性氧化物 | |
| B. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2的质子数相同,互为同位素 | |
| C. | 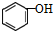 与 与 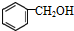 互为同系物 互为同系物 | |
| D. | 淀粉、纤维素和蛋白质都属于高分子化合物 |
12.可在有机物中引入羟基的反应类型( )
①取代、②加成、③消去、④酯化、⑤氧化、⑥还原.
①取代、②加成、③消去、④酯化、⑤氧化、⑥还原.
| A. | ①②③ | B. | ①②⑤⑥ | C. | ①④⑤⑥ | D. | ①②③⑥ |
9.下列化学用语的表示不正确的是( )
| A. | Na2S的电子式: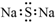 | |
| B. | HClO的结构式:H-O-Cl | |
| C. | 2,2-二甲基丙烷的结构简式: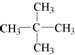 | |
| D. | 氯离子结构示意图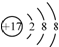 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
16. 某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )
某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )
 某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )
某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )| A. | 利用I、II装置制取气体(K2关闭、K1打开),可以收集H2等气体,但不能收集02、NO气体 | |
| B. | 利用II装置作简单改进(但不改变瓶口朝向)后,可以收集O2、NO等气体,但不能收集NO2气体 | |
| C. | 利用I、Ⅲ装置可以比较H2S04、H2CO3和H2SiO3的酸性强弱 | |
| D. | 利用I、Ⅲ装置既能验证氧化性:Ca(ClO)2>Cl2>Br2,又能保护环境 |
6.对于已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂( )
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂( )
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ④⑥ |
13.某种只含Al、Fe、Cu的合金,称取a g样品,设计下列实验流程分析该合金的组成

下列相关叙述正确的是( )

下列相关叙述正确的是( )
| A. | 若向溶液F中加入K4[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液F中含有Fe2+ | |
| B. | 溶液N为深蓝色,说明溶液N中含大量Cu2+ | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
10.MnO2和锌是制造干电池的主要原料
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
[软锰矿、闪锌矿]$\stackrel{步骤①:硫酸}{→}$[滤液A]$\stackrel{步骤②:金属棒}{→}$[Zn2+、Mn2+、Fe2+、Al3+]$\stackrel{步骤③:物质C}{→}$
[ZnSO4、MnSO4溶液]$\stackrel{步骤④:电解}{→}$[Zn+MnO2+产品D]
已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
[软锰矿、闪锌矿]$\stackrel{步骤①:硫酸}{→}$[滤液A]$\stackrel{步骤②:金属棒}{→}$[Zn2+、Mn2+、Fe2+、Al3+]$\stackrel{步骤③:物质C}{→}$
[ZnSO4、MnSO4溶液]$\stackrel{步骤④:电解}{→}$[Zn+MnO2+产品D]
已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
11.草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4•2H2O工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是还原Fe3+、Co3+为Fe2+、Co2+.
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
(5)萃取剂对金属离子的萃取率与pH的关系如1图所示,在滤液Ⅱ中适宜萃取的pH为3.0~3.5左右.

(6)已知:
NH3•H2O?NH4++OH- Kb=1.8×10-5
H2C2O4?H++H2CO4- K${\;}_{{a}_{1}}$=5.4×10-2
H2CO4-?H+C2O42- K${\;}_{{a}_{2}}$=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是Co3O4.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
(5)萃取剂对金属离子的萃取率与pH的关系如1图所示,在滤液Ⅱ中适宜萃取的pH为3.0~3.5左右.

(6)已知:
NH3•H2O?NH4++OH- Kb=1.8×10-5
H2C2O4?H++H2CO4- K${\;}_{{a}_{1}}$=5.4×10-2
H2CO4-?H+C2O42- K${\;}_{{a}_{2}}$=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是Co3O4.