题目内容
11.下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填写在横线上:苯(甲苯)KMnO4酸性溶液及NaOH溶液;苯(乙醇)水;甲苯(溴)氢氧化钠溶液.
分析 甲苯易被酸性高锰酸钾氧化;乙醇乙溶于水,而苯不溶于水,溴可与氢氧化钠溶液反应,以此解答该题.
解答 解:甲苯能够酸性的高锰酸钾氧化生成苯甲酸,苯甲酸与氢氧化钠发生酸碱中和反应生成苯甲酸钠溶液,苯与酸性的高锰酸钾不反应,可以用KMnO4酸性溶液及NaOH溶液出去苯中的甲苯;
乙醇乙溶于水,可用水萃取分离;
溴能够与氢氧化钠溶液反应生成易溶于水的溴化钠和次溴酸钠,而甲苯与氢氧化钠溶液不反应,所以可以用氢氧化钠溶液出去甲苯中的溴;
故答案为:KMnO4酸性溶液及NaOH溶液;水;氢氧化钠溶液.
点评 本题考查物质的分离和提纯,为高考常见题型,侧重于考查学生的分析能力和实验能力,注意把握物质的性质的异同,难度不大.

练习册系列答案
相关题目
2.下列关于同分异构体异构方式的说法中,正确的是( )
| A. | CH3CH2CH2CH3和CH3CH(CH3)2属于碳链异构 | |
| B. | 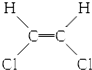 和 和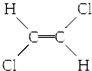 属于位置异构 属于位置异构 | |
| C. | CH2═C(CH3)2和CH3CH═CHCH3属于官能团异构 | |
| D. | CH3CH2CH2COOH和CH3COOCH2CH3属于位置异构 |
19.铁矿石中含铁量的测定,按以下步骤进行:铁矿石中含铁量的测定
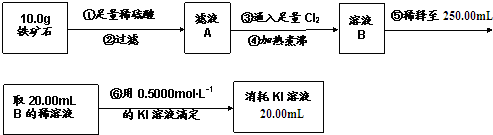
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 步骤④中煮沸的作用是为了除去残留的氯气 | |
| B. | 步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶 | |
| C. | 铁矿石中铁的百分含量为56% | |
| D. | 该铁矿石中若含氧为24%,则铁的氧化物的化学式为Fe2O3•3FeO |
6.对于已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂( )
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂( )
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ④⑥ |
16.1L 0.1mol/L AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断中正确的是( )
| A. | 溶液的浓度变为0.08mol/L | B. | 阳极上产生112ml O2 (标准状况) | ||
| C. | 转移的电子数是1.204×1022 个 | D. | 反应中有0.01mol Ag 被氧化 |
3.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 46g乙醇中存在的共价键总数为7NA | |
| B. | 1mol甲醇完全燃烧时,转移的电子数为6NA | |
| C. | 标准状况下,22.4L甲烷和22.4L氯仿所具有的微粒数均为NA | |
| D. | 1 L 0.1mol/L醋酸溶液中含有的氢离子数为0.1NA |
1.氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性.NCl3的相关性质如下:

回答下列问题:
(1)根据实验目的,接口连接的顺序为1-4-5-2-3-6-710-9-8
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为NaOH溶液.
(3)A装置中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色..
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |

回答下列问题:
(1)根据实验目的,接口连接的顺序为1-4-5-2-3-6-710-9-8
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为NaOH溶液.
(3)A装置中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色..
 由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.
由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.