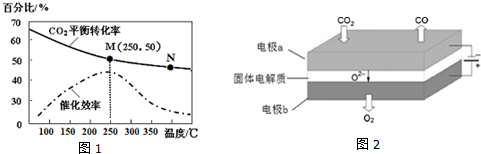
题目内容
14.某化工厂采用稀NaOH溶液脱除CO2.若碱洗脱除后所得废液的pH约为13(已知:相同温度下饱和Na2CO3溶液的pH约为12),则下列说法正确的是( )| A. | 该溶液中:c(OH-)>c(Na+)>c(CO32-)>c(HCO3-)>c(H+) | |
| B. | 该溶液中:c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-) | |
| C. | 加水稀释该溶液,恢复至原温度,pH增大,Kw不变 | |
| D. | 该溶液pH约为13的原因:CO32-+H2O═HCO3-+OH- |
分析 相同温度下饱和Na2CO3溶液的pH约为12,而所得废液的pH约为13,说明反应后溶质为NaOH和Na2CO3的混合液,
A.反应后溶质为NaOH和Na2CO3的混合液,则c(Na+)>c(OH-);
B.根据混合液中的电荷守恒判断;
C.稀释后溶质浓度减小,溶液中氢氧根离子浓度减小,溶液的pH减小;
D.碳酸根离子的水解为可逆反应,应该用可逆号.
解答 解:相同温度下饱和Na2CO3溶液的pH约为12,而所得废液的pH约为13,说明反应后溶质为NaOH和Na2CO3的混合液,
A.由于溶质为碳酸钠和氢氧化钠的混合物,则溶液中一定满足:c(Na+)>c(OH-),故A错误;
B.该溶液中一定满足电荷守恒:c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-),故B正确;
C.该溶液为碱性溶液,稀释后溶液中氢氧根离子浓度减小,溶液的pH减小,故C错误;
D.该溶液中氢氧化钠电离出氢氧根离子、碳酸根离子水解,溶液呈碱性,且碳酸根离子的水解应该用可逆号,正确的离子方程式为:CO32-+H2O?HCO3-+OH-,故D错误;
故选B.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
5.某温度下,水的离子积为Kw,该温度下将a mol•L-1的一元酸HA与b mol•L-1的一元碱BOH等体积混合,若混合溶液显中性必须满足的条件是( )
| A. | a=b | B. | c(H+)=c(OH-)=10-7mol/L | ||
| C. | 混合液中Kw=c2(OH-) | D. | c(H+)+c(B+)=c(OH-)+c(A-) |
2.下列关于同分异构体异构方式的说法中,正确的是( )
| A. | CH3CH2CH2CH3和CH3CH(CH3)2属于碳链异构 | |
| B. |  和 和 属于位置异构 属于位置异构 | |
| C. | CH2═C(CH3)2和CH3CH═CHCH3属于官能团异构 | |
| D. | CH3CH2CH2COOH和CH3COOCH2CH3属于位置异构 |
9.下列化学用语的表示不正确的是( )
| A. | Na2S的电子式: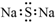 | |
| B. | HClO的结构式:H-O-Cl | |
| C. | 2,2-二甲基丙烷的结构简式: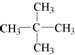 | |
| D. | 氯离子结构示意图 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
19.铁矿石中含铁量的测定,按以下步骤进行:铁矿石中含铁量的测定
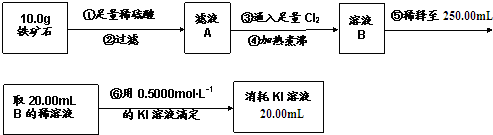
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 步骤④中煮沸的作用是为了除去残留的氯气 | |
| B. | 步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶 | |
| C. | 铁矿石中铁的百分含量为56% | |
| D. | 该铁矿石中若含氧为24%,则铁的氧化物的化学式为Fe2O3•3FeO |
6.对于已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂( )
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂( )
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ④⑥ |
3.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 46g乙醇中存在的共价键总数为7NA | |
| B. | 1mol甲醇完全燃烧时,转移的电子数为6NA | |
| C. | 标准状况下,22.4L甲烷和22.4L氯仿所具有的微粒数均为NA | |
| D. | 1 L 0.1mol/L醋酸溶液中含有的氢离子数为0.1NA |
4. 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3 (用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
1600℃时固体物质的主要成分为FeO和Fe,该温度下若测得固体混合物中m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为80%(设其它固体杂质中不含Fe、O元素).
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
①能判断CO(g)+3H2(g)?CH4(g)+H2O(g)达到平衡的是bd(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为$\frac{(\frac{0.371}{3.258})^{2}}{0.193×(\frac{1.887}{3.258})^{3}×1{0}^{12}P{a}^{2}}$.
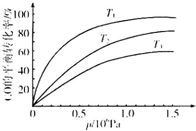
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高.
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为△H2+$\frac{2}{3}$△H3 (用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应 CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0.在T℃,106Pa时将l mol CO和3mol H2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为37.1%;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为$\frac{(\frac{0.371}{3.258})^{2}}{0.193×(\frac{1.887}{3.258})^{3}×1{0}^{12}P{a}^{2}}$.
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是T3>T2>T1,理由是正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高.