题目内容
18.下列说法正确的是( )| A. | 摩尔是一种物理量 | |
| B. | 溶液中或熔融状态下能导电的物质就是电解质 | |
| C. | 氧化还原反应的本质是元素化合价发生了变化 | |
| D. | 得电子的物质被还原,是氧化剂 |
分析 A.摩尔是单位;
B.溶液中或熔融状态下能导电的化合物就是电解质;
C.氧化还原反应的本质是电子的转移;
D.氧化剂得电子,发生还原反应,被还原剂还原.
解答 解:A.摩尔是物质的量的单位,不是物理量,故A错误;
B.在溶液中或熔融状态下能导电的化合物叫做电解质,故B错误;
C.氧化还原反应的本质是电子的转移,氧化还原反应的特征是元素化合价发生了变化,故C错误;
D.在反应中,氧化剂得电子,发生还原反应,被还原剂还原,故D正确;
故选D.
点评 本题考查较为综合,涉及摩尔、电解质、氧化还原反应理论,难度中等,注意氧化还原反应本质和特征的区分.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.设阿伏加德罗常数的值为N0,则下列说法正确的是( )
| A. | 标准状况下,22.4L乙烯含有的共用电子对数为2N0 | |
| B. | 常温下,含有1 mo1 NaHSO4的溶液中阳离子数为N0 | |
| C. | 通常状况下,1 mo1 NO和0.5 mo1 O2在密闭容器中混合,生成NO2分子数为N0 | |
| D. | 制取漂白粉时,标准状况下22.4 L Cl2参加反应,转移电子数为N0 |
9.下列化学用语的表示不正确的是( )
| A. | Na2S的电子式: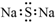 | |
| B. | HClO的结构式:H-O-Cl | |
| C. | 2,2-二甲基丙烷的结构简式: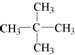 | |
| D. | 氯离子结构示意图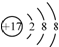 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
6.对于已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂( )
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂( )
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ④⑥ |
13.某种只含Al、Fe、Cu的合金,称取a g样品,设计下列实验流程分析该合金的组成

下列相关叙述正确的是( )

下列相关叙述正确的是( )
| A. | 若向溶液F中加入K4[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液F中含有Fe2+ | |
| B. | 溶液N为深蓝色,说明溶液N中含大量Cu2+ | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
3.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 46g乙醇中存在的共价键总数为7NA | |
| B. | 1mol甲醇完全燃烧时,转移的电子数为6NA | |
| C. | 标准状况下,22.4L甲烷和22.4L氯仿所具有的微粒数均为NA | |
| D. | 1 L 0.1mol/L醋酸溶液中含有的氢离子数为0.1NA |
10.MnO2和锌是制造干电池的主要原料
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
[软锰矿、闪锌矿]$\stackrel{步骤①:硫酸}{→}$[滤液A]$\stackrel{步骤②:金属棒}{→}$[Zn2+、Mn2+、Fe2+、Al3+]$\stackrel{步骤③:物质C}{→}$
[ZnSO4、MnSO4溶液]$\stackrel{步骤④:电解}{→}$[Zn+MnO2+产品D]
已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
[软锰矿、闪锌矿]$\stackrel{步骤①:硫酸}{→}$[滤液A]$\stackrel{步骤②:金属棒}{→}$[Zn2+、Mn2+、Fe2+、Al3+]$\stackrel{步骤③:物质C}{→}$
[ZnSO4、MnSO4溶液]$\stackrel{步骤④:电解}{→}$[Zn+MnO2+产品D]
已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
8. 25℃时,已知:
25℃时,已知:
H2CO3?H++HCO3- K1=4.3×10-7
HCO3-?H++CO32- K2=5.6×10-11
H2O?H++OH- KW=1.0×10-14
现取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示.在25℃时,下列有关溶液中离子浓度关系叙述正确的是( )
 25℃时,已知:
25℃时,已知:H2CO3?H++HCO3- K1=4.3×10-7
HCO3-?H++CO32- K2=5.6×10-11
H2O?H++OH- KW=1.0×10-14
现取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示.在25℃时,下列有关溶液中离子浓度关系叙述正确的是( )
| A. | W 点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH=4 的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | pH=8 的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-) | |
| D. | pH=11 的溶液中:CO32-+H2O HCO3-+OH- K≈1.8×l0-4 |
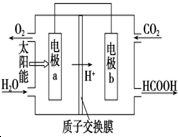 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.