题目内容
17.铅蓄电池反应如下:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,对铅蓄电池工作情况,下列叙述错误的是( )| A. | 放电时Pb极为负极 | |
| B. | 充电时蓄电池上标有“+”号电极连接电源正极 | |
| C. | 放电时正极反应为PbO2+SO42-+4H++2e═PbSO4+2H2O | |
| D. | 充电时蓄电池上标有“-”号的电极发生氧化反应 |
分析 铅蓄电池放电时,负极是Pb、正极是PbO2,负极反应式为Pb+SO42--2e-═PbSO4,正极反应式为SO42-+PbO2+2e-+4H+═PbSO4+2H2O,充电时,负极与外接电源的负极相连,正极与外接电源的正极相连,据此分析解答.
解答 解:A.放电时,失电子的为负极,所以Pb极为负极,故A正确;
B.充电时,正极与外接电源的正极相连,则充电时蓄电池上标有“+”号电极连接电源正极,故B正确;
C.放电时PbO2得电子发生还原反应,则电极反应式为SO42-+PbO2+2e-+4H+═PbSO4+2H2O,故C正确;
D.充电时,负极与外接电源的负极相连,作阴极,阴极上发生得电子的还原反应,故D错误;
故选D.
点评 本题考查原电池和电解池原理,明确得失电子与电极关系、电极反应式的书写是解本题关键,难点是电极反应式的书写,题目难度不大.

练习册系列答案
相关题目
8.设阿伏加德罗常数的值为N0,则下列说法正确的是( )
| A. | 标准状况下,22.4L乙烯含有的共用电子对数为2N0 | |
| B. | 常温下,含有1 mo1 NaHSO4的溶液中阳离子数为N0 | |
| C. | 通常状况下,1 mo1 NO和0.5 mo1 O2在密闭容器中混合,生成NO2分子数为N0 | |
| D. | 制取漂白粉时,标准状况下22.4 L Cl2参加反应,转移电子数为N0 |
5.某温度下,水的离子积为Kw,该温度下将a mol•L-1的一元酸HA与b mol•L-1的一元碱BOH等体积混合,若混合溶液显中性必须满足的条件是( )
| A. | a=b | B. | c(H+)=c(OH-)=10-7mol/L | ||
| C. | 混合液中Kw=c2(OH-) | D. | c(H+)+c(B+)=c(OH-)+c(A-) |
12.可在有机物中引入羟基的反应类型( )
①取代、②加成、③消去、④酯化、⑤氧化、⑥还原.
①取代、②加成、③消去、④酯化、⑤氧化、⑥还原.
| A. | ①②③ | B. | ①②⑤⑥ | C. | ①④⑤⑥ | D. | ①②③⑥ |
2.下列关于同分异构体异构方式的说法中,正确的是( )
| A. | CH3CH2CH2CH3和CH3CH(CH3)2属于碳链异构 | |
| B. | 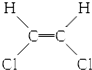 和 和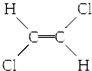 属于位置异构 属于位置异构 | |
| C. | CH2═C(CH3)2和CH3CH═CHCH3属于官能团异构 | |
| D. | CH3CH2CH2COOH和CH3COOCH2CH3属于位置异构 |
9.下列化学用语的表示不正确的是( )
| A. | Na2S的电子式: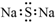 | |
| B. | HClO的结构式:H-O-Cl | |
| C. | 2,2-二甲基丙烷的结构简式: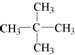 | |
| D. | 氯离子结构示意图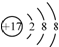 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
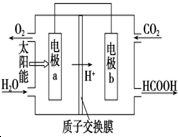 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.