题目内容
2.下列反应中能量变化与其它三个不同的是( )| A. | 铝热反应 | B. | 燃料燃烧 | ||
| C. | 酸碱中和反应 | D. | Ba(OH)2•8H2O与NH4Cl固体混合 |
分析 常见的放热反应有:所有的物质燃烧、金属与酸或水反应、中和反应、铝热反应、绝大多数化合反应、食物腐败、炸药爆炸等;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),Ba(OH)2•8H2O和NH4Cl反应等
解答 解:A.铝热反应是放热反应,故A错误;
B.所有的燃烧反应都是放热反应,故B错误;
C.酸碱中和反应是放热反应,故C错误;
D.Ba(OH)2•8H2O与NH4Cl固体混合是吸热反应,故D正确;
故选D.
点评 本题考查吸热反应和放热反应,难度不大,明确常见的吸热反应和放热反应类型是解题的关键,注意基础知识的积累.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
2.下列生活常识与化学原理有关,其中说法错误的是( )
| A. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| B. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| C. | 明矾水解形成氢氧化铝胶体能杀菌消毒,可用水的净化 | |
| D. | 硫酸亚铁补铁剂应与维生素C同服,是因为维生素C可以防止Fe2+被氧化 |
10.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 某密闭容器盛有0.1molN2和0.3molH2,充分反应后,形成的N-H键数目为0.6NA | |
| B. | 若由CO2和O2组成的混合物共有NA个分子,则其中所含的氧原子数为2NA | |
| C. | 常温下,1L0.1mol/LNH4NO3溶液中的氢原子数为0.4NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体(标况下)时,电路中通过的电子数目为2NA |
17.下列叙述正确的是( )
| A. | 硫酸可以用于除去锅炉或水壶中的水垢 | |
| B. | 切开的苹果放置后变色和纸张久置后变黄的原理相同 | |
| C. | 蜂蚁蛰咬人时会向人体注入酸性物质,可涂抹小苏打溶液缓解疼痛 | |
| D. | 工业含酸废水可用氢氧化钡溶液处理后再排放,有利于减少水体污染 |
7.下列说法不正确的是( )
| A. | 明矾可做消毒剂 | |
| B. | 铝制品抛光车间须严格控制粉尘浓度以防爆炸 | |
| C. | 氧化铝可作耐火材料 | |
| D. | 金属铝无需经过特别处理就具有抗腐蚀能力 |
12. X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):
请回答:
(1)Z2Y2的电子式为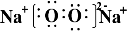 ,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、
,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、
(2)Z2Y2遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为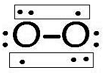 ,其分子空间构型为直线型.
,其分子空间构型为直线型.
(3)X、Y、Z、W四种元素所形成的单质中,硬度最大的是金刚石(填物质的名称);晶体ZW的熔点比晶体XW4明显高的原因是NaCl为离子晶体而CCl4为分子晶体;XW4中X原子的杂化轨道类型为sp3.
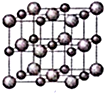
(4)ZW晶体的结构示意图如图所示.设该晶体的摩尔质量为M g/mol,晶体的密度为ρ g/cm3.阿伏伽德罗常数为NA,则晶体中两个最近的Z离子中心间的距离=$\frac{\sqrt{2}}{2}$$\root{3}{\frac{4M}{ρ{N}_{A}}}$.
 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
(1)Z2Y2的电子式为
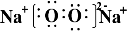 ,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、
,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、(2)Z2Y2遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为
 ,其分子空间构型为直线型.
,其分子空间构型为直线型.(3)X、Y、Z、W四种元素所形成的单质中,硬度最大的是金刚石(填物质的名称);晶体ZW的熔点比晶体XW4明显高的原因是NaCl为离子晶体而CCl4为分子晶体;XW4中X原子的杂化轨道类型为sp3.
(4)ZW晶体的结构示意图如图所示.设该晶体的摩尔质量为M g/mol,晶体的密度为ρ g/cm3.阿伏伽德罗常数为NA,则晶体中两个最近的Z离子中心间的距离=$\frac{\sqrt{2}}{2}$$\root{3}{\frac{4M}{ρ{N}_{A}}}$.