题目内容
19.如图装置是实验室制取乙烯的装置,反应原理是C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O,但反应过程中往往伴随着副反应发生而影响产率.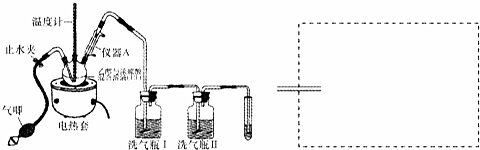
(1)装置中仪器A的名称是冷凝管.
(2)实验开始,开启电热装置,三颈瓶中温度逐渐升高,当温度达到100℃后,三颈瓶中溶液开始出现棕色,随后慢慢变成黑色,该现象体现了浓硫酸的脱水性.同时,还会产生刺激性气味气体,用化学方程式解释产生该气体的原因C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(3)加热至140℃时,会产生乙醚,化学方程式为2C2H5OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O,该反应的反应类型是b.
a.加成反应 b.取代反应 c.消去反应 d.氧化反应
(4)继续加热至170℃,开始产生乙烯,为得到相对纯净的乙烯,洗气瓶Ⅰ中装有NaOH溶液,洗气瓶Ⅱ中装有品红溶液,试管中装有高锰酸钾酸性溶液.洗气瓶Ⅱ中溶液的作用是证明二氧化硫已经完全被氢氧化钠溶液吸收,确保收集的气体是相对纯净的乙烯.
(5)当高锰酸钾酸性溶液褪色时,将试管部分换成收集装置,开始收集乙烯.请再虚线框中绘制出乙烯的装置图.
(6)实验结束,停止加热,卸下乙烯收集装置;丙打开止水夹,挤压气唧,目的是将装置中剩余的二氧化硫排入NaOH溶液完全吸收,防止污染空气.
分析 (1)根据仪器的构造和常见仪器的名称进行分析;
(2)乙醇含有碳、氢、氧三种元素,浓硫酸具有脱水性,三颈瓶中温度逐渐升高,当温度达到100℃后,三颈瓶中溶液开始出现棕色,随后慢慢变成黑色,为碳单质,浓硫酸具有强的氧化性,产生刺激性气味气体为二氧化硫,浓硫酸与碳发生反应生成二氧化碳、二氧化硫和水;
(3)a.加成反应是有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应;
b.取代反应是有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应;
c.消去反应是指在一定条件下,有机物脱去小分子生成分子中含有双键的不饱和有机物的反应;
d.物质与氧发生的化学反应叫氧化反应,或元素化合价升高的反应属于氧化反应;
(4)制取的乙烯气体中含有二氧化硫、二氧化碳等酸性气体,需用碱液吸收,洗气瓶Ⅱ中装有能与二氧化硫作用有显著特征的反应,证明酸性气体已被完全吸收,试管中装有高锰酸钾酸性溶液检验乙烯的生成;
(5)当高锰酸钾酸性溶液褪色时,通过试管部分的气体为乙烯,根据乙烯的物理性质选择收集装置;
(6)实验结束,停止加热,卸下乙烯收集装置;丙打开止水夹,挤压气唧,通过排气法将装置中剩余的二氧化硫压入吸收液中,防止污染空气.
解答 解:(1)装置中仪器A有进水出水的两个支管为冷凝装置,所以A为冷凝管,
故答案为:冷凝管;
(2)三颈瓶中温度逐渐升高,当温度达到100℃后,三颈瓶中溶液开始出现棕色,随后慢慢变成黑色,是因为浓硫酸具有脱水性,将乙醇中氢和氧按水的组成脱去,脱水生成碳单质,浓硫酸具有强氧化性,碳和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:脱水;C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(3)浓硫酸和乙醇的混合液(3:1)加热至140℃发生分子间脱水反应2C2H5OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O,生成乙醚,乙醇没有不饱和键,不属于加成反应,乙醚分子中无不饱和键,不属于消去反应,该反应无化合价变化,不属于氧化反应,两个乙醇分子反应,相当于一个乙醇分子中的一个氢原子被另一乙醇分子中乙基取代,属于取代反应,
故答案为:b;
(4)浓硫酸具有强氧化性,制取的乙烯气体中含有二氧化硫、二氧化碳等酸性气体,需用碱液吸收,可用盛有氢氧化钠的洗气瓶进行洗涤,二氧化硫能漂白品红,洗气瓶Ⅱ中装有能与二氧化硫作用有显著特征的反应,可用品红,证明酸性气体已被完全吸收,试管中装有高锰酸钾酸性溶液,乙烯能被高锰酸钾溶液氧化5CH2=CH2+12KMnO4+18H2SO4→10CO2+12MnSO4+28H2O+6K2SO4,导致高锰酸钾溶液褪色,试管中装有高锰酸钾酸性溶液检验乙烯的生成;
故答案为:NaOH;品红;证明二氧化硫已经完全被氢氧化钠溶液吸收,确保收集的气体是相对纯净的乙烯;
(5)当高锰酸钾酸性溶液褪色时,通过试管部分的气体为乙烯,乙烯的密度与空气接近,不能用排空气法收集,乙烯难溶于水,需用排水法收集,可用如下装置收集, ,
,
故答案为: ;
;
(6)实验结束,停止加热,装置中剩余二氧化硫,二氧化硫为大气污染物,所以,卸下乙烯收集装置;丙打开止水夹,挤压气唧,通过排气法将装置中剩余的二氧化硫压入NaOH溶液中,被完全吸收,防止污染空气,
故答案为:将装置中剩余的二氧化硫排入NaOH溶液完全吸收,防止污染空气.
点评 本题考查了实验室制取乙烯,侧重考查副产物的性质和除杂,反应原理和题干条件的分析判断、信息应用是解题关键,题目难度中等.

| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排除就开始滴定 | |
| C. | 往锥形瓶中加待测液时,锥形瓶中有少许水 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
| A. | 某密闭容器盛有0.1molN2和0.3molH2,充分反应后,形成的N-H键数目为0.6NA | |
| B. | 若由CO2和O2组成的混合物共有NA个分子,则其中所含的氧原子数为2NA | |
| C. | 常温下,1L0.1mol/LNH4NO3溶液中的氢原子数为0.4NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体(标况下)时,电路中通过的电子数目为2NA |
| A. | 明矾可做消毒剂 | |
| B. | 铝制品抛光车间须严格控制粉尘浓度以防爆炸 | |
| C. | 氧化铝可作耐火材料 | |
| D. | 金属铝无需经过特别处理就具有抗腐蚀能力 |
| A. | As的原子半径大于P,AsH3比PH3的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | Al2O3和MgO均可与NaOH溶液反应 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
①CH3OOCCOOCH3(g)+2H2(g)?HOCH2COOH3(g)+CH3OH(g)△H1=a kJ/mol
②HOCH2COOCH3(g)+2H2(g)?HOCH2CH2OH(g)+CH3OH(g)△H2=b kJ/mol
③HOCH2CH2OH(g)+H2(g)?C2H5OH(g)+H2O(g)△H3=c kJ/mol
(1)写出478K时草酸二甲酯催化加氢合成乙二醇的热化学方程式:CH3OOCCOOCH3(g)+4H2(g)?HOCH2CH2OH(g)+2CH3OH(g)△H=(a+b)kJ/mol.
(2)下表是各反应在不同温度下的平衡常:
| 反应/K/温度 | 458K 478K 488K |
| ① ② ③ | 1.78×104 1.43×104 1.29×104 1.91×107 1.58×107 1.45×107 8.11×108 3.12×108 2.00×108 |
②下列有关反应②的说法中,正确的是AB(选填号).
A.较低温度有利于反应②自发进行
B.恒容条件下,当反应混合气体的平均摩尔质量不再改变时,反应达到了平衡
C.升高温度,有利于提高乙二醇的产率
D.增加氢气的浓度,一定既能加快反应的速率,又能提高乙二醇的百分含量
(3)分析图1、图2,选择工业上合成乙二醇的最佳压强n(H2):n(草酸二甲酯)比例C(选填编号).
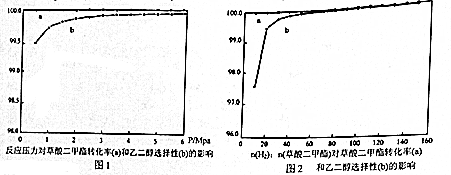
A.0~1Mpa,n(H2):n(草酸二甲酯)=40 B.1~2Mpa,n(H2):n(草酸二甲酯)=20
C.2~3Mpa,n(H2):n(草酸二甲酯)=40 D.2~3Mpa,n(H2):n(草酸二甲酯)=20
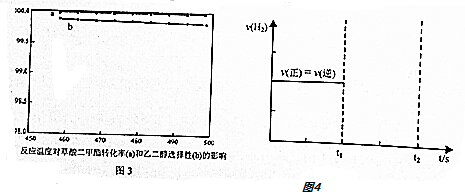
(4)图3表示温度对反应的影响,试分析工业上合成乙二醇时,实际温度不高也不低,选择在473K的理由?此反应的催化剂在473K时催化活性最好.
(5)对反应①,在478K、恒压条件下,充入草酸二甲酯和H2各2mol,一段时间后达平衡,若在t1时刻再充入各1mol的反应物(其它条件不变),t2时重新达到平衡,请在图4中画出正逆反应速率随时间变化的示意图.
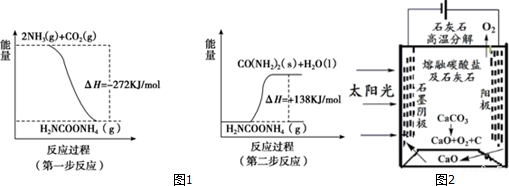
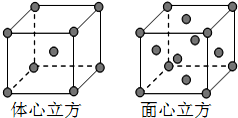 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: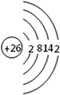 .
.