题目内容
A~H 8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题:
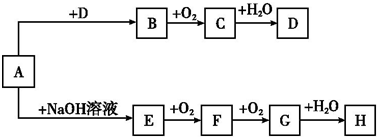
(1)写出下列物质的化学式:A ,B ,C .
(2)写出下列反应的化学方程式:E→F: G→H: D的浓溶液与木炭反应的方程式:
(3)检验某溶液中是否含D中阴离子的方法是 .

(1)写出下列物质的化学式:A
(2)写出下列反应的化学方程式:E→F:
(3)检验某溶液中是否含D中阴离子的方法是
考点:无机物的推断
专题:推断题
分析:G是红棕色气体,则G是NO2,F和氧气反应生成二氧化氮,所以F是NO;A是正盐,和氢氧化钠反应生成E,E和氧气反应生成NO,则E是NH3,A是铵盐;二氧化氮和水反应后能生成H,是和水反应生成硝酸,所以H是硝酸;B能使品红溶液褪色,且B能和氧气反应生成C,所以B是SO2,C是SO3,三氧化硫和水反应生成D为硫酸,A是正盐且是铵盐,反应后能生成二氧化硫,所以A是(NH4)2SO3,以此解答该题.
解答:
解:G是红棕色气体,则G是NO2,F和氧气反应生成二氧化氮,所以F是NO;A是正盐,和氢氧化钠反应生成E,E和氧气反应生成NO,则E是NH3,A是铵盐;二氧化氮和水反应后能生成H,是和水反应生成硝酸,所以H是硝酸;B能使品红溶液褪色,且B能和氧气反应生成C,所以B是SO2,C是SO3,三氧化硫和水反应生成D为硫酸,A是正盐且是铵盐,反应后能生成二氧化硫,所以A是(NH4)2SO3,
(1)通过以上分析知,A是(NH4)2SO3,B为SO2,C为SO3,故答案为:(NH4)2SO3;SO2;SO3;
(2)E→F是在催化剂、加热条件下,氨气和氧气反应生成一氧化氮和水,反应方程式为:4NH3+5O2
4NO+6H2O;
G→H是二氧化氮和水反应生成硝酸和一氧化氮,化学方程式为:3NO2+H2O=2HNO3+NO;
加热条件下,碳和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓)
2SO2↑+CO2↑+2H2O,
故答案为:4NH3+5O2
4NO+6H2O;3NO2+H2O=2HNO3+NO;C+2H2SO4(浓)
2SO2↑+CO2↑+2H2O;
(3)D为硫酸,检验硫酸根离子,可先加入盐酸,如无现象,可排除阴离子和亚硫酸根离子的影响,然后加入氯化钡溶液,如生成沉淀,则可证明硫酸根离子的存在,
故答案为:取少量该溶液于试管中,加入盐酸,如无现象,再加入氯化钡溶液,如生成沉淀,则可证明硫酸根离子的存在.
(1)通过以上分析知,A是(NH4)2SO3,B为SO2,C为SO3,故答案为:(NH4)2SO3;SO2;SO3;
(2)E→F是在催化剂、加热条件下,氨气和氧气反应生成一氧化氮和水,反应方程式为:4NH3+5O2
| ||
| △ |
G→H是二氧化氮和水反应生成硝酸和一氧化氮,化学方程式为:3NO2+H2O=2HNO3+NO;
加热条件下,碳和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓)
| ||
故答案为:4NH3+5O2
| ||
| △ |
| ||
(3)D为硫酸,检验硫酸根离子,可先加入盐酸,如无现象,可排除阴离子和亚硫酸根离子的影响,然后加入氯化钡溶液,如生成沉淀,则可证明硫酸根离子的存在,
故答案为:取少量该溶液于试管中,加入盐酸,如无现象,再加入氯化钡溶液,如生成沉淀,则可证明硫酸根离子的存在.
点评:本题考查无机物推断,为高考常见题型,侧重于学生的分析能力的考查,涉及N、S元素化合物性质及相互转化,物质的颜色是推断突破口,难度中等.

练习册系列答案
相关题目
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图.下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图.下列说法正确的是( )| A、元素Y与元素Z的最高正化合价之和的数值等于9 |
| B、离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| C、原子半径的大小顺序为:rZ>rW>rQ>rX>rY |
| D、元素W的氢化物稳定性和还原性均比Q的强 |