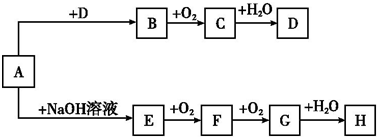
题目内容
如表是元素周期表的一部分,回答下列有关问题:
(1)g的元素符号是 ,k的元素名称是 .a与f可以形成一种硬度大、耐高温的陶瓷材料,该物质的化学式是 .
(2)元素a的氢化物的电子式为 ,
(3)上述元素最高价氧化物对应的水化物中,最强的酸是 ,最强的碱是 ,呈两性的是 ,以上三者可两两相互反应,请将其中两个反应分别用离子方程式表示 、 .
(4)上述元素中能结合成XY型离子化合物、且阴阳离子均为10电子结构的物质的电离方程式 ,常温下该溶液PH 7(填写>、=或<).
(5)从原子结构角度解释c的金属性强于d的原因是 .b、h、k均可与H2反应,其原因是 .
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | ||
| 4 | j | k |
(2)元素a的氢化物的电子式为
(3)上述元素最高价氧化物对应的水化物中,最强的酸是
(4)上述元素中能结合成XY型离子化合物、且阴阳离子均为10电子结构的物质的电离方程式
(5)从原子结构角度解释c的金属性强于d的原因是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)由元素在周期表中位置,可知a为N,b为F,c为Na、d为Mg,e为Al,f为Si,g为S,h为Cl,j为K,k为Br;
(2)元素a的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(3)上述元素最高价氧化物对应的水化物中,最强的酸是高氯酸,K的金属性最强,故KOH的碱性最强,氢氧化铝属于两性氢氧化物,氢氧化铝与高氯酸反应生成高氯酸铝与水,与氢氧化钠反应生成偏铝酸钠与水,高氯酸与氢氧化钠反应生成高氯酸钠与水;
(4)上述元素中能结合成XY型离子化合物、且阴阳离子均为10电子,该化合物为NaF,溶液中氟离子水解,溶液呈碱性;
(5)根据核电荷数与原子半径大小分析金属性强弱原因;根据非金属性分析b、h、k均可与H2反应.
(2)元素a的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(3)上述元素最高价氧化物对应的水化物中,最强的酸是高氯酸,K的金属性最强,故KOH的碱性最强,氢氧化铝属于两性氢氧化物,氢氧化铝与高氯酸反应生成高氯酸铝与水,与氢氧化钠反应生成偏铝酸钠与水,高氯酸与氢氧化钠反应生成高氯酸钠与水;
(4)上述元素中能结合成XY型离子化合物、且阴阳离子均为10电子,该化合物为NaF,溶液中氟离子水解,溶液呈碱性;
(5)根据核电荷数与原子半径大小分析金属性强弱原因;根据非金属性分析b、h、k均可与H2反应.
解答:
解:由元素在周期表中位置,可知a为N,b为F,c为Na、d为Mg,e为Al,f为Si,g为S,h为Cl,j为K,k为Br;k的名称为溴,a与f可以形成一种硬度大、耐高温的陶瓷材料,该物质的化学式是Si3N4,故答案为:S;溴;Si3N4;
(2)元素a的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为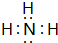 ,故答案为:
,故答案为: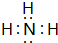 ;
;
(3)元素的最高价氧化物对应水化物中,酸性最强的是HClO4.K的金属性最强,则碱性最强的必是KOH,在表中所列元素的最高价氧化物对应水化物中,只有Al(OH)3具有两性,
氢氧化铝与高氯酸反应生成高氯酸铝与水,离子方程式为:3H++Al(OH)3=Al3++3H2O,
氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
高氯酸与氢氧化钠反应生成高氯酸钠与水,离子方程式为:H++OH-=H2O,
故答案为:HClO4;KOH;Al(OH)3;3H++Al(OH)3=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O(或H++OH-=H2O);
(4)上述元素中能结合成XY型离子化合物、且阴阳离子均为10电子,该化合物为NaF,电离方程式为:NaF=Na++F-,溶液中氟离子水解,溶液呈碱性,即溶液pH>7,故答案为:NaF=Na++F-;>;
(5)Na的核电荷数比Mg小,而原子半径比Mg大,原子核对最外层电子吸引力比Mg弱,故Na更容易失去电子,金属性比Mg强;
F、Cl、Br的非金属性强,单质氧化性强,能与氢气发生反应生成相应的氢化物,
故答案为:Na的核电荷数比Mg小,而原子半径比Mg大,原子核对最外层电子吸引力比Mg弱,Na更容易失去电子;F、Cl、Br的非金属性强,单质氧化性强.
(2)元素a的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为
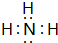 ,故答案为:
,故答案为: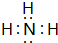 ;
;(3)元素的最高价氧化物对应水化物中,酸性最强的是HClO4.K的金属性最强,则碱性最强的必是KOH,在表中所列元素的最高价氧化物对应水化物中,只有Al(OH)3具有两性,
氢氧化铝与高氯酸反应生成高氯酸铝与水,离子方程式为:3H++Al(OH)3=Al3++3H2O,
氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
高氯酸与氢氧化钠反应生成高氯酸钠与水,离子方程式为:H++OH-=H2O,
故答案为:HClO4;KOH;Al(OH)3;3H++Al(OH)3=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O(或H++OH-=H2O);
(4)上述元素中能结合成XY型离子化合物、且阴阳离子均为10电子,该化合物为NaF,电离方程式为:NaF=Na++F-,溶液中氟离子水解,溶液呈碱性,即溶液pH>7,故答案为:NaF=Na++F-;>;
(5)Na的核电荷数比Mg小,而原子半径比Mg大,原子核对最外层电子吸引力比Mg弱,故Na更容易失去电子,金属性比Mg强;
F、Cl、Br的非金属性强,单质氧化性强,能与氢气发生反应生成相应的氢化物,
故答案为:Na的核电荷数比Mg小,而原子半径比Mg大,原子核对最外层电子吸引力比Mg弱,Na更容易失去电子;F、Cl、Br的非金属性强,单质氧化性强.
点评:本题考查元素周期表与元素周期律综合应用,侧重对化学用语与元素周期律的考查,需要学生具备扎实的基础,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (3)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是
(3)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是 化学反应产生的各种能量是人类探索太空所需能量的重要来源.
化学反应产生的各种能量是人类探索太空所需能量的重要来源.