题目内容
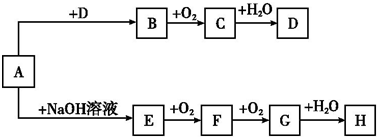
A、B、C、D均是前四周期元素组成的常见不同单质或化合物.它们之间有如下转化关系:A
B
C
D
(1)若A、B、C、D都是氧化物,且A为光导纤维的主要材料,试写出③化学反应方程式:
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是 ,C盐水溶液PH 7 (填“>”“<”“=”).
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是 (填“小写”字母).
a.A可能是一种耐火材料; b. B的溶液一定呈碱性;c.C 一定既溶于盐酸又溶于苛性钠溶液;
若A为金属单质,则用1molA金属制备C,最少需 mol HCl和 mol NaOH.
| ① |
| ② |
| ③ |
(1)若A、B、C、D都是氧化物,且A为光导纤维的主要材料,试写出③化学反应方程式:
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是
a.A可能是一种耐火材料; b. B的溶液一定呈碱性;c.C 一定既溶于盐酸又溶于苛性钠溶液;
若A为金属单质,则用1molA金属制备C,最少需
考点:无机物的推断
专题:推断题
分析:(1)A为光导纤维的主要材料,应为SiO2,A、B、C、D都是氧化物,则反应①应为SiO2和C的反应,B为CO,则C为CO2,D应为MgO;
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,应为Fe3O4,则A为Fe,D是一种红褐色沉淀,应为Fe(OH)3,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,应为Fe(NO3)3;
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,C应为Al(OH)3,B、D分别含有Al3+、AlO2-,A可能为Al或氧化铝,以此解答该题.
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,应为Fe3O4,则A为Fe,D是一种红褐色沉淀,应为Fe(OH)3,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,应为Fe(NO3)3;
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,C应为Al(OH)3,B、D分别含有Al3+、AlO2-,A可能为Al或氧化铝,以此解答该题.
解答:
解:(1)A为光导纤维的主要材料,应为SiO2,A、B、C、D都是氧化物,则反应①应为SiO2和C的反应,B为CO,则C为CO2,D应为MgO,③化学反应方程式为2Mg+CO2
2MgO+C,
故答案为:2Mg+CO2
2MgO+C;
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,应为Fe3O4,则A为Fe,D是一种红褐色沉淀,应为Fe(OH)3,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,应为Fe(NO3)3,反应②的离子方程式是3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,Fe3+水解呈酸性,溶液pH<7,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;<;
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,C应为Al(OH)3,B、D分别含有Al3+、AlO2-,
a.A如为氧化铝,则是一种耐火材料,故a正确;
b. B如为氯化铝,则溶液呈酸性,故b错误;
c.C为氢氧化铝,为两性氢氧化物,一定既溶于盐酸又溶于苛性钠溶液,故c正确.
用1molAl金属制备Al(OH)3,可分别生成Al3+、AlO2-,然后混合发生Al3++3AlO2-+6H2O=4Al(OH)3,此时消耗盐酸和氢氧化钠的量最少,则应生成0.25molAl3+,需要0.75molHCl,生成0.75molAlO2-,需要0.75molNaOH,
故答案为:ac;0.75;0.75.
| ||
故答案为:2Mg+CO2
| ||
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,应为Fe3O4,则A为Fe,D是一种红褐色沉淀,应为Fe(OH)3,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,应为Fe(NO3)3,反应②的离子方程式是3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,Fe3+水解呈酸性,溶液pH<7,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;<;
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,C应为Al(OH)3,B、D分别含有Al3+、AlO2-,
a.A如为氧化铝,则是一种耐火材料,故a正确;
b. B如为氯化铝,则溶液呈酸性,故b错误;
c.C为氢氧化铝,为两性氢氧化物,一定既溶于盐酸又溶于苛性钠溶液,故c正确.
用1molAl金属制备Al(OH)3,可分别生成Al3+、AlO2-,然后混合发生Al3++3AlO2-+6H2O=4Al(OH)3,此时消耗盐酸和氢氧化钠的量最少,则应生成0.25molAl3+,需要0.75molHCl,生成0.75molAlO2-,需要0.75molNaOH,
故答案为:ac;0.75;0.75.
点评:本题以Mg、Al、Fe及其化合物为载体考查了金属元素及其化合物的推断,为高频考点,侧重于学生的分析能力的考查,根据物质的颜色变化及性质为突破口,熟悉物质性质是解本题关键,再结合物质间的转化来解答,题目难度中等.

练习册系列答案
相关题目
设NA代表阿伏加德罗常数的数值,下列说法不正确的是( )
| A、36g镁在足量的二氧化碳气体中完全燃烧共转移的电子数为3NA |
| B、1L 1mol?L-1的Na2CO3溶液中含有Na+的数目为NA |
| C、标准状况下,2.24L CO2和SO2混合气体中含有的氧原子数目为0.2NA |
| D、常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA |