题目内容
已知在25℃时,碳酸和亚硫酸的电离平衡常数为别为:
碳酸 K1=4.30×10-7 K2=5.61×10-11
亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式:K1= .
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性从强到弱顺序为 .
(3)向Na2CO3溶液中加入足量NaHSO3溶液,反应的离子方程式为 .
碳酸 K1=4.30×10-7 K2=5.61×10-11
亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式:K1=
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性从强到弱顺序为
(3)向Na2CO3溶液中加入足量NaHSO3溶液,反应的离子方程式为
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)碳酸的第一级电离方程式为H2CO3?H++HCO3-,电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值;
(2)根据H2CO3、HCO3-和HSO3-的电离平衡常数确定酸性的强弱;
(3)化学反应遵循强酸制弱酸的规律.
(2)根据H2CO3、HCO3-和HSO3-的电离平衡常数确定酸性的强弱;
(3)化学反应遵循强酸制弱酸的规律.
解答:
解:(1)碳酸的第一级电离方程式为H2CO3?H++HCO3-,电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值,则K1=
,
故答案为:
;
(2)H2CO3、HCO3-和HSO3-的电离平衡常数分别是:4.30×10-7、5.61×10-11、1.02×10-7,所以酸性顺序是:H2CO3>HSO3->HCO3-,故答案为:H2CO3>HSO3->HCO3-;
(3)化学反应遵循强酸制弱酸的规律,酸性:HSO3->HCO3-,向Na2CO3溶液中加入足量NaHSO3溶液,反应的离子方程式为CO32-+HSO3-=HCO3-+SO32-,故答案为:CO32-+HSO3-=HCO3-+SO32-.
| c(H+)?c(HCO3-) |
| c(H2CO3) |
故答案为:
| c(H+)?c(HCO3-) |
| c(H2CO3) |
(2)H2CO3、HCO3-和HSO3-的电离平衡常数分别是:4.30×10-7、5.61×10-11、1.02×10-7,所以酸性顺序是:H2CO3>HSO3->HCO3-,故答案为:H2CO3>HSO3->HCO3-;
(3)化学反应遵循强酸制弱酸的规律,酸性:HSO3->HCO3-,向Na2CO3溶液中加入足量NaHSO3溶液,反应的离子方程式为CO32-+HSO3-=HCO3-+SO32-,故答案为:CO32-+HSO3-=HCO3-+SO32-.
点评:本题考查学生弱电解质电离平衡常数的应用知识,注意知识的归纳和整理是关键,难度中等.

练习册系列答案
相关题目
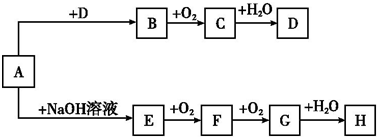
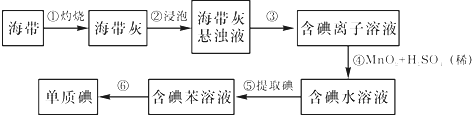
 化学反应产生的各种能量是人类探索太空所需能量的重要来源.
化学反应产生的各种能量是人类探索太空所需能量的重要来源.