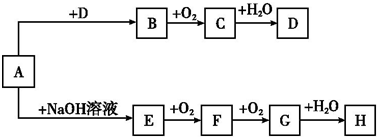
题目内容
现有25℃时0.1mol?L-1的氨水.请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中
(填“增大”、“减小”或“不变”).
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式: ;所得溶液的pH 7(填“<”、“=”或“>”),用离子方程式表示其原因 .
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时
)=a mol?L-1,
)则= .
(1)若向氨水中加入少量硫酸铵固体,此时溶液中
| c(OH-) |
| c(NH3?H2O) |
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时
| c(NH | + 4 |
| c(SO | 2- 4 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)向氨水中加入少量硫酸铵固体,铵根离子浓度增大,抑制氨水的电离,溶液中氢氧根离子浓度减小,氨水分子浓度增大;
(2)硫酸和氨水反应生成硫酸铵和水,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性;
(3)根据溶液中阴阳离子所带电荷相等确定硫酸根离子浓度.
(2)硫酸和氨水反应生成硫酸铵和水,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性;
(3)根据溶液中阴阳离子所带电荷相等确定硫酸根离子浓度.
解答:
解:(1)由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,抑制氨水电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以此时溶液中液中
减小;
故答案为:减小;
(2)硫酸和氨水反应生成硫酸铵和水,离子反应方程式为NH3.H2O+H+=NH4++H2O,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性,水解方程式为:NH4++H2O?NH3.H2O+H+;
故答案为:NH3?H2O+H+=NH4++H2O,<,NH4++H2O?NH3?H2O+H+;
(3)溶液呈中性,则溶液中c(H+)=c(OH-),溶液呈电中性,溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO42- )+c(OH-),所以c(SO42- )=0.5c(NH4+)=0.5amol/l;
故答案为:0.5amol/l.
| c(OH-) |
| c(NH3?H2O) |
故答案为:减小;
(2)硫酸和氨水反应生成硫酸铵和水,离子反应方程式为NH3.H2O+H+=NH4++H2O,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性,水解方程式为:NH4++H2O?NH3.H2O+H+;
故答案为:NH3?H2O+H+=NH4++H2O,<,NH4++H2O?NH3?H2O+H+;
(3)溶液呈中性,则溶液中c(H+)=c(OH-),溶液呈电中性,溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO42- )+c(OH-),所以c(SO42- )=0.5c(NH4+)=0.5amol/l;
故答案为:0.5amol/l.
点评:本题考查了弱电解质的电离、盐类的水、离子浓度大小的比较等知识点,难度不大,离子浓度大小的比较是学习的难点也是考试的热点,根据物料守恒和电荷守恒来进行分析即可.

练习册系列答案
相关题目
下列化学用语书写正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、丙烯的键线式: |
C、CH4分子的比例模型: |
D、乙醇的结构式: |