题目内容
四种短周期元素W、X、Y、Z,其原子的最外层电子数之和为19,W和X元素原子的质子数之比为1:2,Y的核外电子数比X多4,X2+和Z-离子的电子数之差为8.下列说法中,正确的是( )
| A、原子半径大小:Z>Y>X>W |
| B、Y、Z两种元素的氧化物对应的水化物酸性为:Y<Z |
| C、X、Y、Z三种元素的单质均既有氧化性又有还原性 |
| D、W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:根据X2+和Z-离子的电子数之差为8,由元素周期表确定X2+为Be2+或Mg2+;推断Z为F-或Cl-;依据W和X元素原子内质子数之比为1:2,判断W为He或C,结合原子最外层电子数之和为19,所以两种判断中:W:He;X:Be;Z:F时,Y的最外层电子数为8,与Y的核外电子数比X多4不符;若各元素为W:C:X:Mg;Z:Cl;由最外层电子数之和为19,Y的最外层电子数为6,确定Y为S,综上所述:推断出各物质为:W、C;X、Mg;Y、S;Z、Cl,以此解答该题.
解答:
解:根据X2+和Z-离子的电子数之差为8,由元素周期表确定X2+为Be2+或Mg2+;推断Z为F-或Cl-;依据W和X元素原子内质子数之比为1:2,判断W为He或C,结合原子最外层电子数之和为19,所以两种判断中:W:He;X:Be;Z:F时,Y的最外层电子数为8,与Y的核外电子数比X多4不符;若各元素为W:C:X:Mg;Z:Cl;由最外层电子数之和为19,Y的最外层电子数为6,确定Y为S,综上所述:推断出各物质为:W、C;X、Mg;Y、S;Z、Cl,
A.由以上分析可知,原子半径应为X(Mg)>Y(S)>Z(Cl)>W(C),故A错误;
B.非金属性Cl>S,如是最高价氧化物的水化物,则酸性为:Y<Z,如不是最高价,则不一定,故B错误;
C.Mg单质只有还原性,故C错误;
D.非金属性Cl>S>C,元素的非金属性越强,对应的氢化物越稳定,故D正确.
故选D.
A.由以上分析可知,原子半径应为X(Mg)>Y(S)>Z(Cl)>W(C),故A错误;
B.非金属性Cl>S,如是最高价氧化物的水化物,则酸性为:Y<Z,如不是最高价,则不一定,故B错误;
C.Mg单质只有还原性,故C错误;
D.非金属性Cl>S>C,元素的非金属性越强,对应的氢化物越稳定,故D正确.
故选D.
点评:本题考查了原子结构和元素周期律,同时考查学生发散思维能力,注意把握元素周期律的递变规律以及原子结构特点,结合元素周期律解答,注意B选项中没有明确是最高价氧化物的水化物,注意审题,为易错点.

练习册系列答案
相关题目
下列溶液中离子浓度的关系一定正确的是( )
| A、等物质的量的弱酸HA与其钾盐KA的混合溶液中:2c(K+)=c(HA)+c(A-) |
| B、pH相同的CH3COONa溶液、Ba(OH)2溶液、KHCO3溶液:c(K+)>c(Na+)>c(Ba2+) |
| C、氨水中逐滴加入盐酸得到的酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=3的一元酸HA溶液和pH=11的一元碱MOH溶液等体积混合:c(M+)=c(A-)>c(H+)=c(OH-) |
用酒精灭菌消毒,可使细菌和病毒蛋白质的生理活性发生变化.这种变化属于( )
| A、水解 | B、变性 |
| C、盐析 | D、颜色反应 |
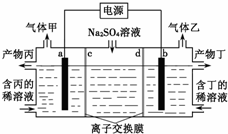 电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是( )(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是( )(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)| A、a电极反应式为:2H++2e-═H2↑ |
| B、产物丙为硫酸溶液 |
| C、离子交换膜d为阴离子交换膜 |
| D、每转移0.1 mol电子,产生1.12 L的气体乙 |
下列说法不正确的是( )
| A、已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
| B、SO2、SO3都是极性分子 |
| C、实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 |
| D、金属具有的光泽是金属吸收光子而发生跃迁发出特定波长的光波 |
用立式隔膜电解槽电解食盐水时,下列叙述错误的是( )
| A、石墨作阳极 |
| B、铁作阴极 |
| C、阳极连接电源的负极 |
| D、产品烧碱和氢气在阴极区产生 |
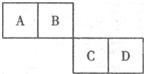 已知A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,它们的原子序数之和为46.请填空:
已知A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,它们的原子序数之和为46.请填空: