题目内容
下列溶液中离子浓度的关系一定正确的是( )
| A、等物质的量的弱酸HA与其钾盐KA的混合溶液中:2c(K+)=c(HA)+c(A-) |
| B、pH相同的CH3COONa溶液、Ba(OH)2溶液、KHCO3溶液:c(K+)>c(Na+)>c(Ba2+) |
| C、氨水中逐滴加入盐酸得到的酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=3的一元酸HA溶液和pH=11的一元碱MOH溶液等体积混合:c(M+)=c(A-)>c(H+)=c(OH-) |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
B.pH相等的这三种溶液,氢氧化钡是强碱,其浓度最小,弱酸根离子水解程度越大其溶液浓度越小;
C.混合溶液呈酸性,则c(H+)>c(OH-),如果溶液中盐酸的物质的量大于氯化铵,则存在c(NH4+)<c(H+);
D.混合溶液可能呈中性、酸性或碱性.
B.pH相等的这三种溶液,氢氧化钡是强碱,其浓度最小,弱酸根离子水解程度越大其溶液浓度越小;
C.混合溶液呈酸性,则c(H+)>c(OH-),如果溶液中盐酸的物质的量大于氯化铵,则存在c(NH4+)<c(H+);
D.混合溶液可能呈中性、酸性或碱性.
解答:
解:A.任何电解质溶液中都存在物料守恒,根据物料守恒得2c(K+)=c(HA)+c(A-),故A正确;
B.pH相等的这三种溶液,氢氧化钡是强碱,其浓度最小,弱酸根离子水解程度越大其溶液浓度越小,酸根离子水解程度HCO3->CH3COO-,则这三种溶液浓度大小顺序是CH3COONa>KHCO3>Ba(OH)2,故B错误;
C.混合溶液呈酸性,则c(H+)>c(OH-),如果溶液中盐酸的物质的量大于氯化铵,则存在c(NH4+)<c(H+),故C错误;
D.如果酸是强酸、碱是弱碱,二者等体积混合后溶液呈碱性,如果酸和碱都是强电解质,则二者等体积混合后溶液呈中性,如果酸是弱酸、碱是强碱,二者混合后溶液呈酸性,所以混合溶液可能呈中性、酸性或碱性,故D错误;
故选A.
B.pH相等的这三种溶液,氢氧化钡是强碱,其浓度最小,弱酸根离子水解程度越大其溶液浓度越小,酸根离子水解程度HCO3->CH3COO-,则这三种溶液浓度大小顺序是CH3COONa>KHCO3>Ba(OH)2,故B错误;
C.混合溶液呈酸性,则c(H+)>c(OH-),如果溶液中盐酸的物质的量大于氯化铵,则存在c(NH4+)<c(H+),故C错误;
D.如果酸是强酸、碱是弱碱,二者等体积混合后溶液呈碱性,如果酸和碱都是强电解质,则二者等体积混合后溶液呈中性,如果酸是弱酸、碱是强碱,二者混合后溶液呈酸性,所以混合溶液可能呈中性、酸性或碱性,故D错误;
故选A.
点评:本题考查离子浓度大小比较,明确物质的性质及混合溶液酸碱性是解本题关键,再结合守恒思想分析解答,易错选项是CD,注意正确判断C选项中是否含有盐酸,为易错点.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
将15克甲烷与乙烯的混合气通入盛有溴水(足量)的洗气瓶,反应后测得溴水增重7克,则混合气中甲烷和乙烯的体积比为( )
| A、2:1 | B、1:2 |
| C、3:2 | D、2:3 |
酸雨的形成主要是由于( )
| A、森林遭到乱砍乱伐,破坏了生态环境 |
| B、汽车排出大量尾气 |
| C、大气中二氧化碳的含量增大 |
| D、含硫化石燃料的大量燃烧 |
下列有关电解质溶液中粒子的物质的量浓度关系正确的是( )
| A、在0.1mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1mol?L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO4-)+2c(H2CO3) |
| C、向0.2mol?L-1NaHCO3溶液中加入等体积0.1mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、常温下,pH=7的CH3COONa和CH3COOH混合溶液:c(Na+)+c(CH3COO-)═c(H+)+c(OH-) |
四种短周期元素W、X、Y、Z,其原子的最外层电子数之和为19,W和X元素原子的质子数之比为1:2,Y的核外电子数比X多4,X2+和Z-离子的电子数之差为8.下列说法中,正确的是( )
| A、原子半径大小:Z>Y>X>W |
| B、Y、Z两种元素的氧化物对应的水化物酸性为:Y<Z |
| C、X、Y、Z三种元素的单质均既有氧化性又有还原性 |
| D、W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |
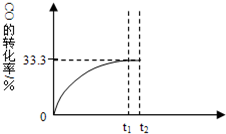 某温度下,向密闭容器中充入2.0mol CO和1.0mol H2O,发生反应:
某温度下,向密闭容器中充入2.0mol CO和1.0mol H2O,发生反应: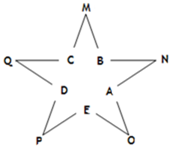 今有A、B、C、D、E五种常见单质,且相邻的单质可生成对应的化合物M、N、O、P、Q(反应关系如图所示),常温下A呈气态,其余均为固态,N分子中各原子均满足八电子稳定结构;又知过量B与A作用产生白雾,B与过量A作用产生白烟;E在A中燃烧产生棕色的烟;Q遇水立刻水解产生白色絮状沉淀和气体,该沉淀能溶于氢氧化钠溶液但不溶于氨水;P为黑色固体且能溶于稀盐酸.试回答下列问题:
今有A、B、C、D、E五种常见单质,且相邻的单质可生成对应的化合物M、N、O、P、Q(反应关系如图所示),常温下A呈气态,其余均为固态,N分子中各原子均满足八电子稳定结构;又知过量B与A作用产生白雾,B与过量A作用产生白烟;E在A中燃烧产生棕色的烟;Q遇水立刻水解产生白色絮状沉淀和气体,该沉淀能溶于氢氧化钠溶液但不溶于氨水;P为黑色固体且能溶于稀盐酸.试回答下列问题: