题目内容
为了测定某铜银合金的成分,将60g的合金完全溶解于160mL 13.5mol/L的浓硝酸中,完全反应后收集到标况下气体13.44L,并测得溶液的C(H+)=1mol/L,假使反应后溶液的体积仍然为160mL,则被还原的硝酸的物质的量是 ;合金中银的质量百分含量是 ;若把收集到的气体与氧气混合恰好完全溶于水,所需标准状况下氧气的体积是 .
考点:有关混合物反应的计算
专题:守恒法
分析:被还原的硝酸生成氮的氧化物(NO、NO2),根据N元素守恒计算被还原的硝酸的物质的量;
由题意可知,反应后硝酸有剩余,由氮元素守恒,n(HNO3)=n(气体)+n剩余(HNO3)+2n[Cu(NO3)2]+n(AgNO3),再结合金属质量之和列方程计算n(Cu)、n(Ag),进而计算Ag的质量分数;
若把收集到的气体与氧气混合恰好完全溶于水,又生成硝酸,纵观整个过程,金属失去电子物质的量等于氧气获得电子物质的量,据此计算氧气的物质的量,进而计算氧气体积.
由题意可知,反应后硝酸有剩余,由氮元素守恒,n(HNO3)=n(气体)+n剩余(HNO3)+2n[Cu(NO3)2]+n(AgNO3),再结合金属质量之和列方程计算n(Cu)、n(Ag),进而计算Ag的质量分数;
若把收集到的气体与氧气混合恰好完全溶于水,又生成硝酸,纵观整个过程,金属失去电子物质的量等于氧气获得电子物质的量,据此计算氧气的物质的量,进而计算氧气体积.
解答:
解:①被还原的硝酸生成氮的氧化物(NO、NO2),根据N元素守恒,被还原的硝酸的物质的量为
=0.6mol;
②由题意可知,反应后硝酸有剩余,由氮元素守恒,n(HNO3)=n(气体)+n剩余(HNO3)+2n[Cu(NO3)2]+n(AgNO3),即n(HNO3)=0.6mol+2n(Cu2+)+n(Ag+)+n(H+),故0.16L×13.5mol/L=0.6mol+2n(Cu)+n(Ag)+0.16L×1mol/L,则2n(Cu)+n(Ag)=1.4mol,
由金属质量之和,可知64g/mol×n(Cu)+108g/mol×n(Ag)=60g
联立方程,解得:n(Cu)=0.6mol; n(Ag)=0.2mol
合金中银的质量分数=
×100%=36%;
③若把收集到的气体与氧气混合恰好完全溶于水,又生成硝酸,纵观整个过程,金属失去电子物质的量等于氧气获得电子物质的量,所需氧气物质的量为:
=0.35mol,所需标准状况氧气体积是:22.4L/mol×0.35mol=7.84L,
故答案为:0.6mol;36%;7.84L.
| 13.44L |
| 22.4L/mol |
②由题意可知,反应后硝酸有剩余,由氮元素守恒,n(HNO3)=n(气体)+n剩余(HNO3)+2n[Cu(NO3)2]+n(AgNO3),即n(HNO3)=0.6mol+2n(Cu2+)+n(Ag+)+n(H+),故0.16L×13.5mol/L=0.6mol+2n(Cu)+n(Ag)+0.16L×1mol/L,则2n(Cu)+n(Ag)=1.4mol,
由金属质量之和,可知64g/mol×n(Cu)+108g/mol×n(Ag)=60g
联立方程,解得:n(Cu)=0.6mol; n(Ag)=0.2mol
合金中银的质量分数=
| 0.2mol×108g/mol |
| 60g |
③若把收集到的气体与氧气混合恰好完全溶于水,又生成硝酸,纵观整个过程,金属失去电子物质的量等于氧气获得电子物质的量,所需氧气物质的量为:
| 0.6mol×2+0.2mol×1 |
| 4 |
故答案为:0.6mol;36%;7.84L.
点评:本题考查混合物计算,难度中等,关键是利用守恒法进行计算,侧重考查学生分析解决问题的能力.

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
四种短周期元素W、X、Y、Z,其原子的最外层电子数之和为19,W和X元素原子的质子数之比为1:2,Y的核外电子数比X多4,X2+和Z-离子的电子数之差为8.下列说法中,正确的是( )
| A、原子半径大小:Z>Y>X>W |
| B、Y、Z两种元素的氧化物对应的水化物酸性为:Y<Z |
| C、X、Y、Z三种元素的单质均既有氧化性又有还原性 |
| D、W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、1Llmol/L的Na2CO3溶液中含有的CO32-数目为NA |
| B、1mol羟基(-OH)所含的电子数约为l0NA |
| C、1mol丙烯分子有2molσ键,1molπ键 |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
两种气态烃的混合气共1mol,在空气中燃烧得到1.5molCO2和2molH2O.关于该混合气的说法合理的是( )
| A、一定含甲烷,不含乙烷 |
| B、一定含乙烷,不含甲烷 |
| C、可能是甲烷和乙烯的混合物 |
| D、一定含甲烷,但不含乙烯 |
自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作宝石.已知该尖晶石中混有Fe2O3.5.68g该样品恰好能完全溶解在100mL一定浓度的盐酸中,则该盐酸的浓度可能是( )
| A、4.6mol/L |
| B、3.2mol/L |
| C、2.5mol/L |
| D、1.2mol/L |
用NA表示阿伏加德罗常数,则下列说法错误的是( )
| A、1 molCH5+所含的电子数为10NA |
| B、1 molC20H42中含有61 NA个共价键 |
| C、25℃时1 mL纯水中含有10-10NA个OH-离子 |
| D、22.4 L的NH3中含有4 NA个原子 |
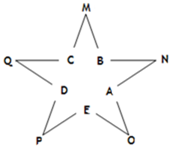 今有A、B、C、D、E五种常见单质,且相邻的单质可生成对应的化合物M、N、O、P、Q(反应关系如图所示),常温下A呈气态,其余均为固态,N分子中各原子均满足八电子稳定结构;又知过量B与A作用产生白雾,B与过量A作用产生白烟;E在A中燃烧产生棕色的烟;Q遇水立刻水解产生白色絮状沉淀和气体,该沉淀能溶于氢氧化钠溶液但不溶于氨水;P为黑色固体且能溶于稀盐酸.试回答下列问题:
今有A、B、C、D、E五种常见单质,且相邻的单质可生成对应的化合物M、N、O、P、Q(反应关系如图所示),常温下A呈气态,其余均为固态,N分子中各原子均满足八电子稳定结构;又知过量B与A作用产生白雾,B与过量A作用产生白烟;E在A中燃烧产生棕色的烟;Q遇水立刻水解产生白色絮状沉淀和气体,该沉淀能溶于氢氧化钠溶液但不溶于氨水;P为黑色固体且能溶于稀盐酸.试回答下列问题: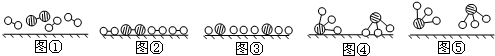
 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程