题目内容
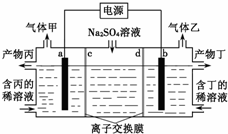 电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是( )(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是( )(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)| A、a电极反应式为:2H++2e-═H2↑ |
| B、产物丙为硫酸溶液 |
| C、离子交换膜d为阴离子交换膜 |
| D、每转移0.1 mol电子,产生1.12 L的气体乙 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:电解硫酸钠溶液时,阳极上生成氧气,电极反应式为2H2O-4e-=O2↑+4H+,阴极反应式为 2H2O+2e-=H2↑+2OH-,测得同温同压下,气体甲与气体乙的体积比约为1:2,则甲是氧气、乙是氢气,则a是阳极、b是阴极,阳极区域生成硫酸、阴极区域生成NaOH,据此分析解答.
解答:
解:电解硫酸钠溶液时,阳极上生成氧气,电极反应式为2H2O-4e-=O2↑+4H+,阴极反应式为 2H2O+2e-=H2↑+2OH-,测得同温同压下,气体甲与气体乙的体积比约为1:2,则甲是氧气、乙是氢气,则a是阳极、b是阴极,阳极区域生成硫酸、阴极区域生成NaOH,
A.a为阳极,电极反应式为2H2O-4e-=O2↑+4H+,故A错误;
B.通过以上分析知,a为阳极,同时生成硫酸,所以产物丙是硫酸,故B正确;
C.产物丁是NaOH,则离子交换膜d是阳离子交换膜,故C错误;
D.生成乙的电极反应式为2H2O+2e-=H2↑+2OH-,每转移0.1 mol电子,产生氢气的物质的量为0.05mol氢气,但温度和压强未知,无法确定气体摩尔体积,则无法计算氢气体积,故D错误;
故选B.
A.a为阳极,电极反应式为2H2O-4e-=O2↑+4H+,故A错误;
B.通过以上分析知,a为阳极,同时生成硫酸,所以产物丙是硫酸,故B正确;
C.产物丁是NaOH,则离子交换膜d是阳离子交换膜,故C错误;
D.生成乙的电极反应式为2H2O+2e-=H2↑+2OH-,每转移0.1 mol电子,产生氢气的物质的量为0.05mol氢气,但温度和压强未知,无法确定气体摩尔体积,则无法计算氢气体积,故D错误;
故选B.
点评:本题考查电解原理,判断甲、乙气体成分是解本题关键,再结合电极反应式分析解答,易错选项是D,注意气体摩尔体积的适用范围及适用条件,为易错点.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
酸雨的形成主要是由于( )
| A、森林遭到乱砍乱伐,破坏了生态环境 |
| B、汽车排出大量尾气 |
| C、大气中二氧化碳的含量增大 |
| D、含硫化石燃料的大量燃烧 |
能发生消去反应、缩聚反应,且能催化氧化生成醛的醇是( )
| A、乙二醇 |
| B、2-甲基-2-丙醇 |
| C、2-丁醇 |
| D、2-甲基-1-丁醇 |
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些酸和醇重新组合可形成的酯共有( )
| A、28种 | B、32种 |
| C、40种 | D、48种 |
金刚石和石墨是由碳元素组成的两种结构不同的单质(同素异形体).在100kPa时,1 mol石墨转化为金刚石,要吸收1.895kJ的热能.据此,试判断在100kPa压强下,下列结论正确的是( )
| A、石墨比金刚石稳定 |
| B、金刚石比石墨稳定 |
| C、1 mol石墨比1 mol 金刚石的总能量高 |
| D、1 mol金刚石比1 mol 石墨的总能量高 |
四种短周期元素W、X、Y、Z,其原子的最外层电子数之和为19,W和X元素原子的质子数之比为1:2,Y的核外电子数比X多4,X2+和Z-离子的电子数之差为8.下列说法中,正确的是( )
| A、原子半径大小:Z>Y>X>W |
| B、Y、Z两种元素的氧化物对应的水化物酸性为:Y<Z |
| C、X、Y、Z三种元素的单质均既有氧化性又有还原性 |
| D、W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、1Llmol/L的Na2CO3溶液中含有的CO32-数目为NA |
| B、1mol羟基(-OH)所含的电子数约为l0NA |
| C、1mol丙烯分子有2molσ键,1molπ键 |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
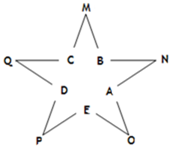 今有A、B、C、D、E五种常见单质,且相邻的单质可生成对应的化合物M、N、O、P、Q(反应关系如图所示),常温下A呈气态,其余均为固态,N分子中各原子均满足八电子稳定结构;又知过量B与A作用产生白雾,B与过量A作用产生白烟;E在A中燃烧产生棕色的烟;Q遇水立刻水解产生白色絮状沉淀和气体,该沉淀能溶于氢氧化钠溶液但不溶于氨水;P为黑色固体且能溶于稀盐酸.试回答下列问题:
今有A、B、C、D、E五种常见单质,且相邻的单质可生成对应的化合物M、N、O、P、Q(反应关系如图所示),常温下A呈气态,其余均为固态,N分子中各原子均满足八电子稳定结构;又知过量B与A作用产生白雾,B与过量A作用产生白烟;E在A中燃烧产生棕色的烟;Q遇水立刻水解产生白色絮状沉淀和气体,该沉淀能溶于氢氧化钠溶液但不溶于氨水;P为黑色固体且能溶于稀盐酸.试回答下列问题: