题目内容
11.K2FeO4是一种新型水处理剂,工业上可用FeSO4制备K2FeO4,其工艺流程如下: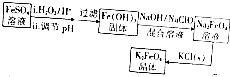
请回答下列问题:
(1)实验室保存硫酸亚铁溶液时,加入少量稀硫酸,其目的是抑制亚铁离子的水解.
(2)写出上述流程中制备高铁酸钠的化学方程式:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O.
(3)高铁酸钠转化成高铁酸钾的原理是高铁酸钠在溶液中溶解大于高铁酸钾.
(4)已知常温下,K甲[Fe(OH)3]=1.0×10-34.离子浓度≤1×10-5mol.L-1时,可认为已完全沉淀.则上述操作中,调节pH的范围应为大于4.3.
(5)高铁酸钾净水原理如下:首先,具有强氧化性的高铁酸钾氧化细菌,高铁酸钾被还原成Fe3+,然后,铁离子水解生成氢氧化铁胶体粒子,胶粒聚沉水中杂质.Fe3+水解包括以下几步反应:
①Fe3+(aq)+H2O(l)?Fe(OH)2+(aq)+H+(aq)K1
②Fe(OH)2+(aq)+H2O(l)?Fe(OH)2+(aq)+H+(aq)K2
③Fe(OH)2++H2O(l)?Fe(OH)3(胶体)+H+(aq)K3
K1、K2、K3的大小排序为K1>K2>K3.
如果废水中酸性过强,不利于净水,其原因是溶液酸性过强会抑制铁离子的水解,不能产生氢氧化铁胶体.
分析 根据反应的流程可知,硫酸亚铁被双氧水氧化,再调节pH值可得氢氧化铁固体,氢氧化铁固体在碱性条件下被次氯酸钠氧化得Na2FeO4溶液,在溶液中加入氯化钾结晶可得K2FeO4,
(1)在保存硫酸亚铁溶液时要防止亚铁离子水解;
(2)氢氧化铁与次氯酸钠反应生成高铁酸钠和氯化钠,利用元素守恒和电子得失守恒书写化学方程式;
(3)根据在溶液中溶解大的物质可以生成溶解度小的物质的原理分析;
(4)调节pH使铁离子沉淀完全,即c(Fe3+)≤1×10-5mol.L-1,根据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)可计算出溶液中氢氧根离子的浓度,进而确定pH值;
(5)多元弱酸弱碱是分步电离的,所以弱碱阳离子也是分步水解的,其中一级水解程度大于二级水解,二级水解程度大于三级水解,据此判断水解平衡常数的大小,溶液酸性过强会抑制铁离子的水解.
解答 解:根据反应的流程可知,硫酸亚铁被双氧水氧化,再调节pH值可得氢氧化铁固体,氢氧化铁固体在碱性条件下被次氯酸钠氧化得Na2FeO4溶液,在溶液中加入氯化钾结晶可得K2FeO4,
(1)在保存硫酸亚铁溶液时要防止亚铁离子水解,所以加入少量的硫酸目的是抑制亚铁离子的水解,
故答案为:抑制亚铁离子的水解;
(2)氢氧化铁与次氯酸钠反应生成高铁酸钠和氯化钠,反应方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O,
故答案为:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O;
(3)高铁酸钠在溶液中溶解大于高铁酸钾,所以铁酸钠在溶液中可以转化成高铁酸钾,
故答案为:高铁酸钠在溶液中溶解大于高铁酸钾;
(4)调节pH使铁离子沉淀完全,即c(Fe3+)≤1×10-5mol.L-1,根据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)可知溶液中c(OH-)=$\root{3}{\frac{1.0×10{\;}^{-34}}{1×1{0}^{-5}}}$=1×$1{0}^{-\frac{29}{3}}$,c(H+)=1×$1{0}^{-\frac{13}{3}}$,所以pH≈4.3,所以要使铁离子完全沉淀,溶液的pH值大于4.3,
故答案为:大于4.3;
(5)多元弱酸弱碱是分步电离的,所以弱碱阳离子也是分步水解的,其中一级水解程度大于二级水解,二级水解程度大于三级水解,所以K1>K2>K3,溶液酸性过强会抑制铁离子的水解,不能产生氢氧化铁胶体,所以不利于净水,
故答案为:K1>K2>K3;溶液酸性过强会抑制铁离子的水解,不能产生氢氧化铁胶体.
点评 本题主要考查化学工艺流程分析,意在考查考生对已学知识的掌握、理解、迁移、转化、重组和解决实际问题的能力.

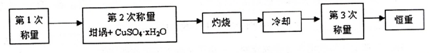
(1)设待测硫酸铜晶体的化学式为CuSO4•xH2O,则该硫酸铜晶体受热失去全部结晶水的化学方程式为CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O.

a.研钵 b.镊子 c.坩埚 d.三角架
(2)下列是实验中用到的几种仪器,仪器与对应名称正确的是ac.(填序号)
(3)“冷却”操作应在干燥器(填仪器名称)中进行,“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是酒精喷灯温度太高,容易使CuSO4受热分解.
(4)恒重操作的目的是确保硫酸铜晶体失水完全.
(5)测定硫酸铜晶体结晶水含量时,若实验结果偏低,原因可能是d.(填序号)
a.坩埚未完全干燥b.加热过程中晶体有少量溅失
c.坩埚上沾有受热不分解的杂质d.加热后未放入干燥器中冷却
(6)下面是某学生实验的一次数据,请完成计算
| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 11.721g | 22.692g | 18.631g | a |
(2)若加热后坩埚与固体总质量为18.631g,实测值x=5.22(保留两位小数)
(3)若理论值x=5,则该实验的相对误差是4.4%.
| A. | 向某无色溶液中加入铁粉能产生大量H2,则该溶液中存在大量Na+、Ca2+、C1-、NO3- | |
| B. | 水电离出的c(H+)=1×10-3mol•L-1的水溶液中Na+、CO32-、Cl-、K+ | |
| C. | pH=1的水溶液中NH4+、Cl-、Mg2+、SO42- | |
| D. | Al3+、HCO3-、I-、Ca2+ |
| A. | 1 mol•L-1 HCN溶液的pH约为3 | |
| B. | HCN易溶于水 | |
| C. | 10 mL 1 mol•L-1 HCN溶液恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 在相同条件下,HCN溶液的导电性比强酸溶液的弱 |

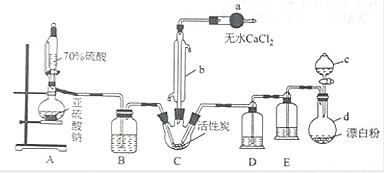 氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的实验装置如图所示:
氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的实验装置如图所示: