题目内容
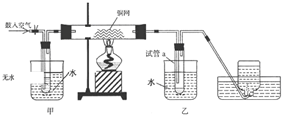
3.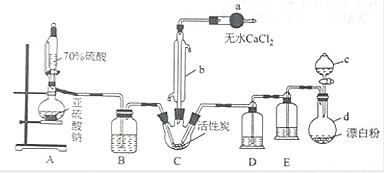 氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的实验装置如图所示:
氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的实验装置如图所示:已知:①SO2(g)+Cl2(g)$\frac{\underline{\;催化剂\;}}{\;}$SO2Cl2(l)△H=-97.3kJ/mol.
②硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”.
③100℃以上开始分解,生成二氧化硫和氯气
(1)仪器a的名称为干燥管,装置B的作用是干燥二氧化硫气体;仪器c的溶液滴入仪器d中所产生的实验现象是烧瓶中有黄绿气体产生.
(2)若装置A中的70%硫酸和亚硫酸钠分别换成浓硫酸和Cu片,几乎不能得到SO2Cl2,原因是浓硫酸和Cu片在不加热的条件下不能产生二氧化硫.
(3)取部分C装置所得的产物于试管中,再向其加水,出现白雾,振荡,静置得到无色溶液.经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl-,证明无色液体是SO2Cl2.
①写出SO2Cl2与H2O反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl;
②检验该溶液中Cl-的方法是在所得溶液中滴加硝酸酸化的硝酸银溶液,若溶液中出现白色沉淀,则说明溶液中有氯离子.
(4)若缺少装置D,氯气和二氧化碳可能发生反应的离子方程式为Cl2+SO2+2H2O=SO42-+2Cl-+4H+.整套装置的缺点是没有尾气吸收装置.
(5)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有②③(填序号).
①加热三颈烧瓶
②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温.
分析 根据装置图可知,A装置中用浓硫酸与亚硫酸钠反应生成二氧化硫,硫酰氯易水解,所以生成的二氧化硫要干燥,所以B中装有浓硫酸,用漂白粉与浓盐酸反应制得氯气,氯气中有氯化氢和水蒸气,所以用饱和食盐水(E)除去氯化氢,用浓硫酸(D)干燥氯气,干燥的二氧化硫和氯气在C中反应生成硫酰氯,
(1)根据装置图可知,仪器a的名称;要用干燥的二氧化硫参加反应;盐酸与漂白粉可以产生氯气;
(2)浓硫酸和Cu片在不加热的条件下不反应,所以不能产生二氧化硫;
(3)①SO2Cl2与H2O反应会生成氯化氢和硫酸,根据元素守恒书写化学方程式;
②检验溶液中Cl-的方法是用硝酸酸化的硝酸银溶液;
(4)若缺少装置D,则有水分进入C装置,氯气和二氧化硫可能反应生成硫酸和氯化氢;实验中二氧化硫、氯气都是有毒气体,会污染空气,而装置中没尾气吸收装置;
(5)由于合成的反应为放热反应,而硫酰氯在100℃以上开始分解,所以反应的温度不能太高,可以通过冷却和控制反应速率的方法,据此答题.
解答 解:根据装置图可知,A装置中用浓硫酸与亚硫酸钠反应生成二氧化硫,硫酰氯易水解,所以生成的二氧化硫要干燥,所以B中装有浓硫酸,用漂白粉与浓盐酸反应制得氯气,氯气中有氯化氢和水蒸气,所以用饱和食盐水(E)除去氯化氢,用浓硫酸(D)干燥氯气,干燥的二氧化硫和氯气在C中反应生成硫酰氯,
(1)根据装置图可知,仪器a的名称为干燥管,要用干燥的二氧化硫参加反应,所以装置B的作用是干燥二氧化硫气体,盐酸与漂白粉可以产生氯气,所以产生的实验现象是烧瓶中有黄绿气体产生,
故答案为:干燥管;干燥二氧化硫气体;烧瓶中有黄绿气体产生;
(2)浓硫酸和Cu片在不加热的条件下不反应,所以不能产生二氧化硫,
故答案为:浓硫酸和Cu片在不加热的条件下不能产生二氧化硫;
(3)①SO2Cl2与H2O反应会生成氯化氢和硫酸,反应的化学方程式为SO2Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
②检验溶液中Cl-的方法是用硝酸酸化的硝酸银溶液,实验操作为在所得溶液中滴加硝酸酸化的硝酸银溶液,若溶液中出现白色沉淀,则说明溶液中有氯离子,
故答案为:在所得溶液中滴加硝酸酸化的硝酸银溶液,若溶液中出现白色沉淀,则说明溶液中有氯离子;
(4)若缺少装置D,则有水分进入C装置,氯气和二氧化硫可能反应生成硫酸和氯化氢,反应的离子方程式为Cl2+SO2+2H2O=SO42-+2Cl-+4H+,实验中二氧化硫、氯气都是有毒气体,会污染空气,而装置中没有尾气吸收装置,所以该实验装置的缺点是没有尾气吸收装置,
故答案为:Cl2+SO2+2H2O=SO42-+2Cl-+4H+;没有尾气吸收装置;
(5)由于合成的反应为放热反应,而硫酰氯在100℃以上开始分解,所以反应的温度不能太高,可以通过冷却和控制反应速率的方法,故选②③.
点评 本题考查实验制备方案,涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 2Fe+4H2O═Fe2O3+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | Ca(OH)2+SO2═CaSO3+H2O | D. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O |
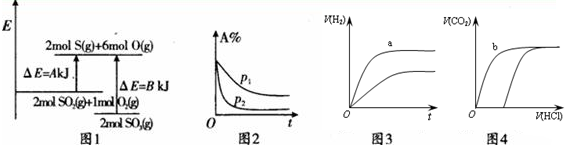
注:△E:表示能量,p表示压强;t表示时间,V表示体积,%表示B的体积百分含量.
| A. | 图1表示化学反应2S02(g)+O2(g)?2S03(g)的能量变化,该反应的△H=A一BkJ/mol | |
| B. | 图2表示其他条件不变时,反应2A(g)+B(g)?c(g)+D(g)在不同压强下随时间的变化 | |
| C. | 图3表示体积和浓度均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | 图4表示100 ml O.1 mol•L-Na2C03和NaHC03两种溶液中,分别逐滴滴加0.1 mol•L-1HCl,产生CO2 的体积随盐酸体积的变化,则b表示NaHCO3溶液 |
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 50 mL 0.5 mol•L-1AlCl3溶液 | ||
| C. | 200 mL 1 mol•L-1NaCl溶液 | D. | 200 mL 2 mol•L-1KClO3溶液 |


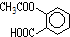 ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
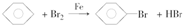 (催化剂也可以写FeBr3).
(催化剂也可以写FeBr3).