题目内容
14.Mg能在NO2中燃烧,产物为Mg3N2、Mg0和N2.某科学小组通过实验验证反应产物并探究产物的比例关系.资料信息:2NO2+2NaOH═NaNO3+NaNO2+H2O;Mg3N2+6H20═3Mg(OH)2+2NH3↑,限用如下装置实验(夹持装置省略,部分仪器可重复使用)

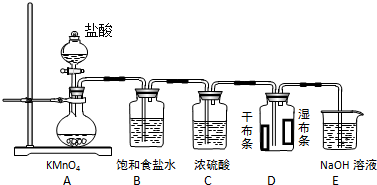
(1)装置连接的顺序为B→A→E→A→F→C→D(填字母序号).
(2)下列描述正确的是BC(填写序号).
A.浓硝酸需保存在棕色试剂瓶中,其目的是放置其挥发
B.连接好仪器,装入药品前需要检验装置气密性
C.装置A中盛装的药品可以为无水CaCl2
D.装置F中NaOH可以用Ca(OH)2代替,装置D可用量筒代替
(3)写出浓硝酸与铜反应的离子方程式Cu+4H++2NO3-═Cu2++2H2O+NO2↑.
(4)验证产物中存在Mg3N2的具体实验操作为取少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色.
(5)假设实验结束后装置F中的溶质只有NaNO3和NaNO2,则溶液中的离子浓度由大到小的顺序为(已知HNO2为弱酸):Na+>NO3->NO2->OH->H+.
(6)已知装置E中初始加入Mg粉质量为26.4g,在足量的NO2中充分燃烧,实验结束后,硬质管冷却至室温、称量,测得硬质管玻璃管中剩余固体的质量为42.0g,产生N2的体积为2240mL(标准状况),写出玻璃管中发生反应的化学方程式:11Mg+4NO2=Mg3N2+8MgO+N2.
分析 (1)Mg能在NO2中燃烧,产物为Mg3N2、Mg0和N2,装置B中Cu与浓硝酸反应生成的气体NO2,用装置A干燥剂干燥,通入硬质玻璃管E与镁粉发生反应,用F装置除去多余的NO2,装置C和D排水法收集N2,为防止F中的水份进入装置使氮化镁水解,在F装置前也要连A装置干燥,据此判断连接装置的顺序;
(2)A.浓硝酸需保存在棕色试剂瓶中,是由于浓硝酸见光或受热易分解;
B.该实验是有气体参加的,所以连接好仪器,装入药品前需要检验装置气密性;
C.装置A的目的主要是吸收二氧化氮气体中的水份,所以A中盛装的药品可以为无水CaCl2;
D.氢氧化钙的溶解度比较小,能吸收的二氧化氮比较少,据此判断;
(3)浓硝酸与铜反应生成二氧化氮、硝酸铜和水,据此书写离子方程式;
(4)取少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色,确定产物中有氮气生成的实验现象为装置C中收集到大量气体;
(5)装置F中的溶质只有NaNO3和NaNO2,且它们的物质的量比为1:1,HNO2为弱酸,所以亚硝酸根离子发生水解,溶液呈碱性,即氢氧根离子浓度大于氢离子浓度,据此判断;
(6)已知装置E中初始加入Mg粉质量为13.2g,物质的量=$\frac{26.4g}{24g/mol}$=1.1mol,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为42.0g为氮化镁和氧化镁,产生N2的体积为2240mL(标准状况)物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,
设生成Mg3N2的物质的量为xmol,MgO的物质的量为Ymol,可得到3x+y=1.1mol,100x+40y=42.0g解得x=0.1,y=0.8,N2的物质的量为0.1mol,据此计算出反应中各物质的物质的量之比,再利用氮原子守恒NO2前系数;
解答 解:(1)Mg能在NO2中燃烧,产物为Mg3N2、Mg0和N2,装置B中Cu与浓硝酸反应生成的气体NO2,用装置A干燥剂干燥,通入硬质玻璃管E与镁粉发生反应,用F装置除去多余的NO2,装置C和D排水法收集N2,为防止F中的水份进入装置使氮化镁水解,在F装置前也要连A装置干燥,故连接装置的顺序为:BAEAFCD,
故答案为:B、A、A、F、C;
(2)A.浓硝酸需保存在棕色试剂瓶中,是由于浓硝酸见光或受热易分解,故A错误;
B.该实验是有气体参加的,所以连接好仪器,装入药品前需要检验装置气密性,故B正确;
C.装置A的目的主要是吸收二氧化氮气体中的水份,所以A中盛装的药品可以为无水CaCl2,故C正确;
D.氢氧化钙的溶解度比较小,能吸收的二氧化氮比较少,所以不能用氢氧化钙代替氢氧化钠,故D错误;
故选BC;
(3)浓硝酸与铜反应生成二氧化氮、硝酸铜和水,反应的离子方程式为Cu+4H++2NO3-═Cu2++2H2O+NO2↑,
故答案为:Cu+4H++2NO3-═Cu2++2H2O+NO2↑;
(4)取少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色,确定产物中有氮气生成的实验现象为装置C中收集到大量气体,证明为生成的氮气,
故答案为:取少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色;
(5)装置F中的溶质只有NaNO3和NaNO2,且它们的物质的量比为1:1,HNO2为弱酸,所以亚硝酸根离子发生水解,溶液呈碱性,即氢氧根离子浓度大于氢离子浓度,所以溶液中的离子浓度由大到小的顺序为Na+>NO3->NO2->OH->H+,
故答案为:Na+>NO3->NO2->OH->H+;
(6)已知装置E中初始加入Mg粉质量为26.4g,物质的量=$\frac{26.4g}{24g/mol}$=1.1mol,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为42.0g为氮化镁和氧化镁,产生N2的体积为2240mL(标准状况)物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol.
设生成Mg3N2的物质的量为xmol,MgO的物质的量为Ymol,可得到3x+y=1.1mol,100x+40y=42.0g
解得x=0.1,y=0.8,N2的物质的量为0.1mol,
n(Mg):n(Mg3N2):n(MgO):n(N2)=1.1:0.1:0.8:0.1=11:1:8:1:,结合氮原子守恒NO2前系数为4,即得到11Mg+4NO2=Mg3N2+8MgO+N2,
故答案为:11Mg+4NO2=Mg3N2+8MgO+N2;
点评 本题考查了物质组成和性质的实验探究方法和组成的测定分析,实验基本操作和物质组成的计算是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 2Fe+4H2O═Fe2O3+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | Ca(OH)2+SO2═CaSO3+H2O | D. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O |
①取少量吸收液于试管中,加入过量的稀盐酸,产生淡黄色浑浊和气体,将所得的气体依次通入品红溶液、足量酸性KMnO4溶液和澄清石灰水,品红褪色,石灰水变浑浊
②另取少量待测液于试管中,加入过量的KClO3固体、AgNO3和稀硝酸,有白色沉淀产生
③另取少量待测液于试管中,酸化后再加入淀粉KI溶液,呈蓝色
④另取少量待测液于试管中,加入足量的BaCl2溶液和稀盐酸,有白色沉淀产生
下列说法正确的是( )
| A. | 由①可推测溶液中一定含大量CO32-、S2-、SO32-、NO3- | |
| B. | 由②可推测溶液中一定含大量NO2- | |
| C. | 由③可推测溶液中一定含大量NO3- | |
| D. | 由实验④难以推测溶液中一定含大量SO42- |
| A. | Na+、SO42-、Cl-、NO3- | B. | Na+、HCO3-、Ca2+、Cl- | ||
| C. | Na+、Cl-、NO3-、Fe3+ | D. | K+、Cl、CO32-、NO3- |
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 50 mL 0.5 mol•L-1AlCl3溶液 | ||
| C. | 200 mL 1 mol•L-1NaCl溶液 | D. | 200 mL 2 mol•L-1KClO3溶液 |